ملخص كيمياء 3 نظام المقررات الفصل الدراسي الاول .
ملخص كيمياء 3
ملخص الفصل الاول حالات المادة : الغازات - قوة التجاذب - المواد السائلة -المواد الصلبة
ملخص الفصل الثاني الطاقة والتغيرات الكيمائية : الطاقة - الحرارة - المعادلة الكيميائية الحرارية - حساب التغير في المحتوة الحراري
ملخص الفصل الثالث : شرعة التفاعل الكيميائي العوامل المؤثرة على سرعة التفاعل - قوانين سرعة التفاعل - قوانين سرعة التفاعل الكيميائي
ملخص الفصل الربع : الاتزان الديناميكي - العوامل المؤثرة على الاتزان الكيميائي - استعمال ثابت الاتزان
ملخص الفصل الخامس : مشتقات المركبات الهيدروكربونية و تفاعلاتها : هاليدات الالكيل وهاليدات الاريل - الكحولات و الايثرات و الامينات - مركبات الكربونيل - تفاعلات اخرة للمركبات العضوية - البوليمرات
خواص الغازات
1 تتمدد بالحرارة 2- لها خاصيتي الانتشار و التدفق 3- كثافتها منخفضة ، علل : لأن جسيماتها متباعدة 4- قابلة للانضغاط 5- جسيماتها صغيرة | 1- الغازات دائما في حركة مستمرة لذلك تطبق نظرية الحركو الجزيئية للغازات 2- جسيمات الغاو تحتوي على طاقة كامنة لهذا السبب تتحرك + نظرية الحركة الجزيئية 3- تنعدم قوة التجاذب و التنافر في الغاز ، علل : لأن الفراغات بين الجسسمات كبيرة 4- الغازات تتصادم فيما بينها تصادم مرن أي ان الجسيمات لا تفقد طاقتها الحركية عن التصادم |
السؤال : على ماذا تعتمد نظرية الحركة الجزيئية ؟
الجواب :
حجم الجسيم - حركة الجسيم - طاقة الجسيم
الضغط : قياس القوة على المساحة
السؤال : من أثبت وجود الضغط ؟
الجواب : العالم الإيطالي
السؤال : ما هو الضغط وكيف نشأ ؟
الجواب : هو القوة الواقعة على وحدة المساحة نشأ نتيجة تحرك الغاز في الغلاف الجوي
السؤال : أجهزة قياس الضغط ؟
الجواب :
1- بارومتر : لقياس الضغط الجوي
2- مانومتر : لقياس الغاز المحصور
3- باسكال : قياس القوة على المساحة
| ملاحظة | ملاحظة | ملاحظة |
| 1 ضغط جوي بقابله 760 ملم من عامود الزئبق | يعتمد الضغط الجزئي للغاز على عدد مولاته وحجم الوعاء و درجة حرارة خليط الغاز ولكنه لا يعتمد على نوع الغاز | يعتمد قانون دالتون على الضغوط الجزيئية لا على الغازات المختلفة |
قوة التجاذب
مقدمة : الاختلاف في قوى التجاذب ينتج عنه اختلاف في حالات المادة سائل - صلب - غاز
 | غاز : الجسميات متباعدة |
 | سائل : متراصة بانتظام |
 | صلب : متراصة عشوائيا |
هناك قوتان في الجزيئات :
1- داخلية : داخل الجزيء
أ- رابطة أيونية ، ب- رابطة فلزية ، ج- رابطة تساهمية
2- خارجية : خارج الجزيء
أ- تشتت ، ب- قطبية فلزية ، هيدروجينية H
1- قوى التشتت : أ- قوة ضعيفة نتجت عن إزاحة الإلكترونات بشكل مؤقت ب- تنشأ بعد إزاحة الإلكترونات قوة ثنائية القطب السؤال : متى تزداد قوة التشتت ؟ الجواب : توداد بزيادة الحجم الذري ( عدد الإلكترونات في الذرة ) السؤال : أيهما أعلى في قوة التشتت ؟ اليود I53 أم البروم Br35 علل ؟ الجواب : اليود لان حجمه أكبر | 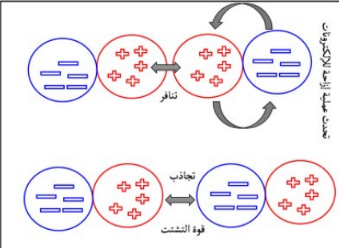 ملاحظة : قوة التشتت تنشأ في المركبات غير القطبية |
2- القوة ثنائية القطب : أ- التعريف : تجاذب بين منطقتين مختلفتي الشحنة - دون إزاحة للإلكترونات ب- الرابطة القطبية أقوى من رابطة التشتت ج- تنشأ فقط في المركبات القطبية مث : حمض الكلور و حمض الفلور | 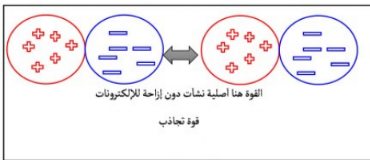 ملاحظة : الجزيئات القطبية الصغيرة تحتوي على قوى ثنائية قطبية عالية |
المواد السائلة
خواصها السؤال : جسيماتها مقيدة علل ؟ الجواب : لوجود قوة التجاذب بين جسيماتها السؤال : السوائل لا يحصل لها انضغاط علل ؟ الجواب : لان جسيماتها متراصة و مترابطة و منتظمة و لا توجد بينها فراغات تطبق النظرية الحركية الجزيئية | السؤال : تعتبر غازات السوائل من الموائع علل ؟ الجواب : لان لها خاصيتي الانسياب و الانتشار 2- اللزوجة : مقياس مقاومة السائل للتدفق 3- التوتر السطحي : الماء . الطاقة اللازمة لزيادة مساحة سطح السائل ، بمقدار معين | 1- التماسك و التلاصق : التماسك : قوة ترابط الجسميات التلاصق : قوة ترابط بين الجسيمات الغير المتماثلة 2- الخاصية الشعرية : مثال : جذور النبات أو المنديل عند امتصاص الماء |
المواد الصلبة
خواصها 1- حركة ثابتة : اهتزازية 2- لا تعد المواد الصلبة من الموائع علل ؟ الجواب : لان ليس لها خاصيتي الانتشار و الانسياب 3- الكثافة أ- الماء : الثلج يطفو على الماء لأن كثافته اقل من الماء ب- البنزين : البنزين الصلب كثافته أعلى من البنزين السائل لذلك يغرق في البنزين السائل | 1- مقيد الحركة : بسبب التجاذب العالي بين جسيماتها 2- المواد الصلبة البلورية ( لها شكل هندسي منتظم ) وحدة البناء أعلى هي أساس الشكل البلوري الهندسي 3- المواد الصلبة غير المتبلورة : 2- درجة انصهارها عالية و يتم تبريدها بشكل عالي مما يجعلها لا تكون الشكل البلوري |
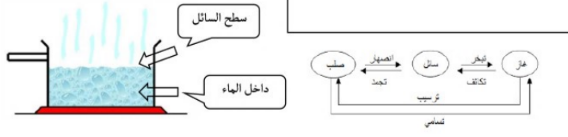
تغيرات المادة الفيزيائية
| تمتص الطاقة ( تكتسب ) | طاردة للطاقة ( تفقد ) |
سائل ـــــــ غاز ( تبخر ) صلب ــــــ سائل ( انصهار ) صلب ـــــ غاز ( تسامي ) | غاز ــــــــ سائل ( تكثف ) سائل ـــــــ صلب ( تجمد ) غاز ــــــ صلب ( ترسيب ) |
التبخر : تحول المادة السائلة إلى غاز الانصهار : الطاقة اللازمة لكسر القوى التي تربط جسيمات الشبكة البلورية التسامي : تحول من الحالة الصلبة إلى الحالة الغازية دون المرور بالحالة السائلة | التكثف : عندما تفقد الجسيمات الطاقة ، تقل سرعتها بالتالي تتكون الروابط الهيدروجينة و عندما تتحول من الحالة الغازية إلى السائلة التجمد : الدرجة الي تتحول فيها المادة السائلة إلى صلب بلوري الترسيب : تحول المادة من الحالة الغازية إلى الصلبة دون المرور بالحالة السائلة |
| الانصهار | التبخر السطحي |
السؤال :تنصهر بعض المركبات عند درجات حرارة ثابتة معروفة ؟ الجواب : لأن لها تركيب ثابت و منتظم السؤال : بعض المركبات غير معروف لها درجات حرارة ثابتة ؟ الجواب : لان لها تركيب غير منتظم ( عشوائي ) ثلج + ماء = تنقل الطاقة من الاعلى حرارة إلى الأقل لذلك يحضل الذوبان | السؤال : يتبخر الماء الموجود على السطح ؟ الجواب : لان الترابط الداخلي أقوى من الترابط في السطح |
.



