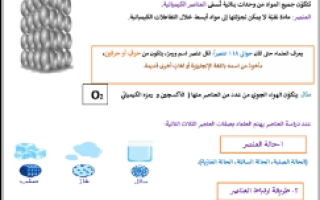
ملخص الوحدة الخامسة (المادة) علوم خامس ابتدائي ف3
تتكون جميع المواد من وحدات بنائية تسمى العناصر الكيميائية
العنصر : مادة نقية لا يمكن تجزئتها إلى مواد ابسط خلال التفاعلات الكيميائية
يعرف العلماء حتى الآن حوالي 118 عنصرا ، لكل عنصر اسم و رمز ، يتكون من حرف أو حرفين مأخوذ من اسمه باللغة الإنجليزية أو لغات أخرى قديمة
مثال : يتكون الهواء الجوي من عدد من العناصر منها ( الاكسجين و رمزه الكيميائي O2 )
عند دراسة العناصر يهتم العلماء بصفات العنصر الثلاث التالية :
1- حالة العنصر :
( الحالة الصلبة ، الحالة السائلة ، الحالة الغازية )
2- طريقة ارتباط العناصر :
بعض العناصر تميل إلى الارتباط مع عناصر اخرى لتكوين مواد جديدة ومن امثلتها الماغنسيوم المستخدم في الالعاب النارية
3- تصنيف العنصر :
تصنف العناصر إلى ثلاثة اصناف هي :
| الفلزات | اللافلزات | شباه الفلزات |
صفات الفلزات اللمعان توصيل الحرارة و الكهرباء . قابليتها للتشكيل | صفات اللافلزات هشة رديئة التوصيل للحرارة و الكهرباء | صفات اشباه الفلزات صفات مشتركة مع الفلزات وصفات اخرى مشتركة مع اللافلزات |
الذرات و الجزيئات
يتكون العنصر من أجزاء اصغر تسمى الذرات
الذرة : اصغر وحدة العنصر تحمل صفات لك العنصر
مم تتكون الذرات و الجزيئات
تتكون ذرات العنصر من الاجزاء التالية :
1- نواة :
وتقع في مركز الذرة و تتكون من نوعين من الجسيمات هما :
أ- البروتونات : وهي جسيمات موجبة الشحنة
ب- نيوترونات : وهي جسيمات متعادلة الشحنة
2- إلكترونات :
سالبة الشحنة تدور في فراغ حول النواة يحتل معظم
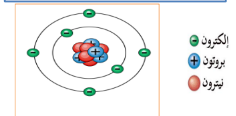
العدد الذري : هو عدد البروتونات في الذرة الذي يحدد نوع العنصر ، تكون الذرة متعادلة كهربائيا ، عدد البروتونات الموجبة = عدد الإلكترونات السالبة
الجزيئات : دقائق تتكون من اتحاد ذرتين أو أكثر معا عندما ترتبط الذرات معا تكون الجزيئات
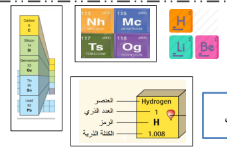
الصيغة الكيميائية
حروف تدل على نوع العنصر و أرقام تدل على عدد الدرات
مثلا : جزيء الاكسجين صيغته الكيميائية ( o2 ) الحرف يدل على نوع الذرات - الرقم يدل على عدد الذرات
تصنيف العناصر
كل عنصر كيميائي له اسم و رمز
يتكون رمز العنصر من حرف او حرفين تستخدم رموز ااعناصر في كتابة المعادلات الكيميائية
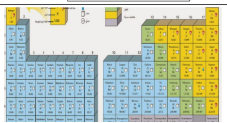
العالم مندليف رتب العناصر من الاخف إلى الأثقل
اكتشف مندليف ان خصائص العناصر تتكرر بشكل دوري

رتب العناصر في جدول سمي ( الجدول الدوري )
حيث تصطف العناصر بعضها بجانب بعض في صفوف تسمى الدورات ، وكل عمود في الجدول الدوري يحتوي على عناصر تتشابه في خصائصها الكيميائية وتسمى مجموعات
مجموعات العناصر الشائعة
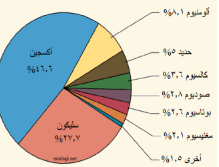
أكثر العناصر شيوعا في الفضاء الخارجي الهيدروجين و الهليوم و يشكل نحو 98.0 من كتلة الكون
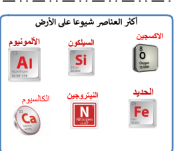
باطن الارض مكون من الحديد الصلب المحاط بالحديد المنصهر
يأتي معظم الاوكسجين و اليهدروجين من الماء ، و نحو 60% من أوزان اجسام الحيوانات يتكون من الماء
تتكون معظم اجسام الحيوانات من عناصر الكروين ، الاكسجين ، الهيدروجين ، النيتروجين ، الفوسفور
الفلزات
تشكل نحو 75 % من العناصر تقع في الجاني الايسر و الاوسط من الجدول الدوري تتميز بـاللمعان القابلية للتوصيل الحراري و الكهربائي سهولة تشكيلها بسبب قابلتيها للرق و السحي توجد جميعها في الحالة الصلبة مقل : الحديد - النحاس - الذهب - الفضة
الزئبق الذي يوجد في الحالة السائلة
يستخدم الحديد في
1- يستخدم الحديد في اعمال البناء و صناعة السيارات
2- يستعمل الالمونيوم في صناعة اوراني الطبخ
3- يستعمل النحاس في صناعة الاسلاك الكهربائية
4- و التيتانيوم يستعملها الاطباء و يثبتونها داخل جسم الإنسان أو في العظام أو حتى في القلب
5- تستعمل الذهب و الفضة في الزينة و صناعة الحلي
اللافلزات
تقع جانب الايمن من الجدول الدوري
غير قابلة لإعادة التشكيل بالطرق أو السحب
الصلب منها قابل للكسر ليس لها رنين غير موصلة للحرارة و الكهرباء توجد بحالات مختلفة
منها الصلب كالكبريت و اليود و الكربون و السائل كالبروم و الغاز كالاكسجين و الهيدروجين و النيتروجين
اشباه الفلزات

تقع أشباه الفلزات في الجانب الايمن من الجدول الدوري و تشترك في خصائصها مع كل من الفلزات واللافلزات.
أشباه الفلزات شبه موصلة للكهرباء؛ فهي توصيل الكهرباء عند درجات الحرارة العالية مثل الفلزات، ولكن عند درجات الحرارة المنخفضة جدا لا توصل الكهرباء مثل اللافلزات.
و لهذا السبب يستعمل السليكون و اشباه الفلزات الاخرى في الالات و رقائق الحاسوب و الدوائر الكهربائية