عرض بوربوينت قانون جاي لوساك كيمياء 2-3 مسارات أ. ماجد الحكمي
قانون شارل
تقويم : استعمل قانون شارل لتحديد صحة بيانات الشكل 7-13
ينص قانون شارل على أن حجم كتلة معينة من الغاز يتناسب تناسبا طرديا مع درجة الحرارة . و يخضع الرسم البياني لهذا القانون لأن مضاعفة درجة الحرارة من شأنها مضاعفة الحجم لذا . فالبيانات دقيقة

قانون جاي - لوساك
سنتعلم اليوم:
1) تَحّدِيد المتغيرات في قانون جاي-لوساك عند ثبوت الحجم .
2) كِتَابَة نص قانون جاي-لوساك .
3) تَوضِيّح نوع العلاقة بين الضغط ودرجة الحرارة بواسطة الرسم البياني.
4) تَطبيق على قانون جاي-لوساك .
قانون جاي - لوساك
التهيئة
سبق أن لاحظت تطبيقات قانون شارل فعند تغير درجة الحرارة ماذا يحدث لحجم البالون ؟
لكن ماذا يحدث لوكان البالون صلباً ثابتاً وإذا كان حجمه ثابتاً فهل هناك علاقة بين درجة الحرارة و الضغط ؟
للإجابة عن هذه التساؤلات لابد أن تتعرف على قانون جاي لوساك
قانون جاي - لوساك
كيف ترتبط درجة الحرارة مع ضغط الغاز؟
كيف ينتج الضغط ؟
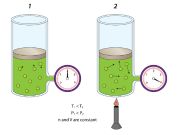
ينتج الضغط عند اصطدام جسيمات الغاز بجدران الوعاء ، فكلما ارتفعت درجات الحرارة زاد عدد الاصطدامات وطاقتها.
لذا تؤدي زيادة الحرارة إلى زيادة الضغط إذا لم يتغير الحجم.
قانون جاي - لوساك
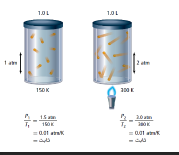
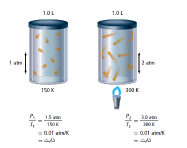
و جد هذا العالم (1778-1850) أن درجة الحرارة المطلقة تتناسب طردياً مع الضغط .
قانون جاي - لوساك
إن ضغط مقدار محدد من الغاز يتناسب طردياً مع درجة الحرارة المطلقة له إذا بقي الحجم ثابتاً .
قانون جاي - لوساك
العلاقة الرياضية لقانون جاي-لوسال
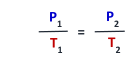
▪حاصل قسمة ضغط كمية محددة من الغاز على درجة حرارته بالكلفن عند ثبوت حجمه يساوي مقداراً ثابتاً.
▪عند استخدام قانون جاي-لوساك يجب التعبير عن درجة الحرارة بالكلفن (K)
P1 : تمثل الضغط الابتدائي
P2 : تمثل الضغط النهائي
T2 : تمثل درجة الحرارة النهائية
T1 : تمثل درجة الحرارة الابتدائية
قانون جاي - لوساك
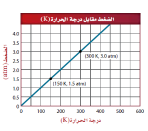
-رسم بياني للعلاقة بين درجة الحرارة و الضغط
▪يوح الرسم البياني أن الضغط ودرجة لحرارة تتناسب تناسباً طردياً.
قانون جاي - لوساك
تدريب1
السؤال : فسر ماذا يحدث داخل قدر الضغط ؟

الجواب : عند زيادة درجة الحرارة عند ثبوت الحجم تزيد من التصادمات بين جزئيات الغاز وبالتالي يزداد الضغط مما يؤدي إلى طهو الطعام بسرعة أكبر.
قانون جاي - لوساك
تدريب2 / ص21
إذا كان ضغط غاز الأكسجين داخل الأسطوانة 5 atm عند درجة حرارة 25⁰C ووضعت الأسطوانة في خيمة على قمة جبل إفرست حيث تكون درجة الحرارة ( -10 ⁰C ) فما الضغط الجديد داخل الأسطوانة ؟

قانون جاي - لوساك
تدريب3 / ص21
افترض أن حجم الغاز ومقداره ثابتان في الآتي (تدريب3 , تدريب 4) :
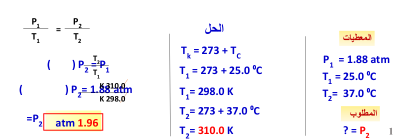
إذا كان ضغط إطار سيارة 1.88 atm عند درجة 25 ⁰C فكم يكون الضغط
إذا ارتفعت درجة الحرارة إلى 37 ⁰C ؟
قانون جاي - لوساك
تدريب3 / ص21
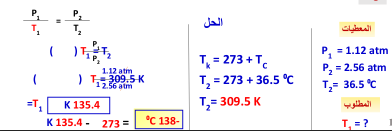
يوجد غاز هيليوم في أسطوانة حجمها 2L ، وتحت تأثير ضغط جوي مقداره 1.12 atm فإذا أصبح ضغط الغاز 2.56 atm عند درجة حرارة 36.5 ⁰C فما قيمة درجة حرارة الغاز الابتدائية ؟
قانون جاي - لوساك
تدريب 5
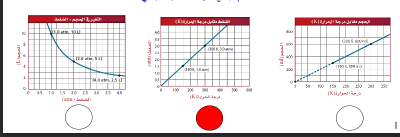
السؤال : حدد الرسم البياني الذي يوضح العلاقة بين المتغيرات التي درسها العالم جاي-لوساك فيما يأتي:
قانون جاي - لوساك
تدريب6
إذا تم زيادة درجة حرارة غاز ضغطه 2.50 atm إلى الضعف فإن..
أ- ضغط الغاز يساوي 1.25 atm
ب- ضغط الغاز يساوي 3.50 atm
ج- ضغط الغاز يساوي 5.0 atm
د- ضغط الغاز لا يتأثر
قانون جاي - لوساك
تدريب7
يربط قانون جاي- لوساك بين المتغيرات التالية:
أ- الضغط والكثافة عند ثبوت درجة الحرارة.
ب- درجة الحرارة والحجم عند ثبوت الضغط.
ج- الضغط والحجم عند ثبوت درجة الحرارة.
د- درجة الحرارة والضغط عند ثبوت الحجم .
قانون جاي - لوساك
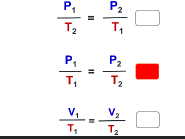
تدريب8
◆العلاقة الرياضية لقانون جاي- لوساك هي:
قانون جاي - لوساك
تقويم:
تحفيز إذا كان ضغط عينة من الغاز يساوي 30.7 kPa عند درجة حرارة 00.0°C، فكم ينبغي أن ترتفع درجة الحرارة السيليزية للعينة حتى يتضاعف ضغطها؟
الجواب :
تعلمنا اليوم
دراسة العلاقة بين درجة الحرارة المطلقة والضغط عند ثبوت الحجم
ينص قانون جاي-لوساك ضغط مقدار محدد من الغاز يتناسب طردياً مع درجة الحرارة المطلقة له إذا بقي الحجم ثابتاً | 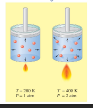 | العلاقة الرياضية 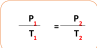 |



