ملخص كيمياء ثاني ثانوي الفصل الثالث
الفصل الأول
( الدرس الدول: مقدمة إلى الهيدروكربونات)
يطلق مصطلح المركبات العضوية على المركبات التي تحتوي على درة: المركب العضوي ماعدا : أكاسيد الكربون ، الكربيدات ، الكربونات
الكربون عنصر يقع في المجموعة 14 من الجدول الدوري والتوزيع الالكترونه له

انواع الروابط بين الكربون:
| إحادية | ثنائية | ثلاثية |
مشبعة غير مشبعة | غير مشبعة متوسطة النشاط | غير مشبعة عالية النشاط |
الهيدروكربونات: تحتوي على عنصري الكربون والهيدرجينفقط في ابسط المركبات
المصادر الرئيسة للهيدروكربونات : النفط و الغاز الطبيعي
طرق العمل المستخدمة لتنقية النفط
1- التقطير الجزئي: تغير النمط لدرجة الغليان
2- التكبير الحراري : تكبيرا لجزيئات الكبيرة إلى مغيرة شروط عملية التكبير
1- وجود عامل مساعد
2- غياب الاكسجين لتفادي حدوث الاحتراق
الدرس الثاني : الالكانات
هي هيدروكربونات على روابط احادية فقط بين الذرات: الألكانات
اسماء الألكانات العشرة ( مهم حفظه)
الصيغة العامة : ( +CnH2n2)
میث ، ایت ، برون ، البيت ، بین ، هکس ، هبت ، اوكن ، النون ، ديك
الالكيلات البسيطة ( الأكثر تكراراً)
| الميثيل | الايثيل | البروبيل |
| CH3 | CH3CH2 | CH3CH2CH2 |
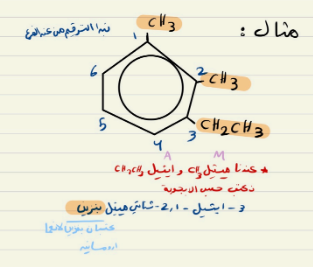
مثال
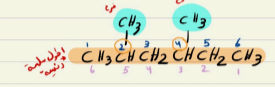
نأخذ الترقيم باللون الازرق نلاحظ عند الفروع الارقام قل من اللون البنفسجي
2،-4 ثنائي ميثيل - هكسان
الإلكانات الحلقية
مركبات لهيدروكربونية تحتوي على روابط احادية
الصيغة العامة ( CnH2n )
*تظهر الالكانات الحلقية من البروبان
الميتان و الايتان لاتظهر فيهم ابداً
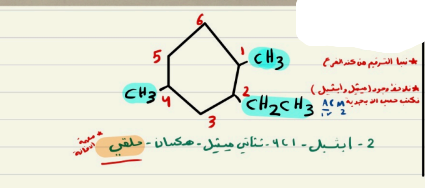
تسمية الالكانات الحلقية
1- نفس التسمية السابقة بإضافة كلمة ( حلقي )
2- الحلقة هي الرئيسية دائما
3- يبدأ الترقيم بالاقرب للتفرع
مثال
الدرس الثالث : ( الالكينات و الالكانات )
الالكينات والالكاينات غير مشبعة وتحتوي على روابط ثنائية وثلاثية واحدة بين ذرات الكربون
الصيغة العامة :
الالكينات ( CnH2n+2 ) ثنائية
الإلكاينات ( CnH2n-2 ) ثلاثية
معلومة مهمة : الميث و والايث لا يكونو روابط ثائية و ثلاثية
السبب : لاحتوائهم على ذرة كربون واحدة
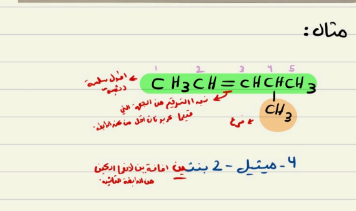
تسمية الالكينات و الالكانات
1- نفس التسمية السابقة بإضافة ( بن) للانكسين و ( اين) للالكساين
2- يبدأ الترقيم من الطرف الأقرب للرابطة = او =
3- في حال وجود أكثر من رابطة = او = يضاف مقطع ( داي ، تراي...) كدليل للتكرار
4- يكتب رقم ذرة الكربون التي تقع بعدها الرابطة = أو =
الدرس الرابع ( متشكلات الهيدروكربونات)
المتشكلات: عبارة عن اثنان أو اكتر من المركبات لهما نفس الصيغة الجزئية ولكن تختلف في الصيغة البنائية
المتشكلات
1- ثنائية ( لها نفس الصيغة الجزئية و تختلف في ترتيب الذرات )
2- مركبة ( لها نفس الصيغة الجزئية و تختلف في الاتجاه ) لهما قسمان
هندسية : تختلف في ترتيب المجموعات واتجاههما حول الرابطة الثنائية
ضوئية :
| سيى | ترانس |
| مجموعة الاكيل نفس الاتجاه | مجموعة الاكيل في عكس الانجاه |
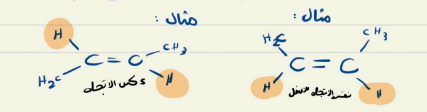
المتشكلات الضوئية و الكيرالية
الضوئية : سميت بذلك لانها تؤثر في الضوء المار بها
الكيرالية : ان يكون للجزيء صورة تشبه صورته في المرآة
شروط الكيرالية :
1- ذرة الكربون ان تحتوي على 4 مجموعات مختلفة
2- دوران ضوئي : يرمز لي اليمين P و اليسار L
سؤال : هل يمكن للتركيب سيى لتحول إلى ترانس ؟
الجواب : لا ، لان ذرات الكربون الثنائية قاعدة على الدروان لذلك تركيب سيى لا يستطيع التحول إلى ترانس
الدرس الخامس " ( الهيدروكربونات الأوزماتية )
تسمية المركبات الازوماتية : علل تسمية الالكانات الحلقية ، ترقم الحلقة بحيث تأخذ التفرعات أقل الارقام
الهيدروكربونات
| مركبات الفاتية | مركبات اروماتية |
| مركب دهني | مركب عطري البنزين الاستخدامات ص 43 |
علماء
1- مداداي : اكتشف البنزين
2- كيكوي : اكتشف الحلقة السداسية
3- باولبغ : فسر النشاط الكيميائي للبزنين
الجواب : لان الكثافة الالكترونية متمركزى أو مستقرة
مثال
جدول مهم
| نوع الرابطة | الالكانات إحادية | الالكينات ثنائية | الالكنيات ثلاثية |
| الصيغة العامة | CnH2n+2 | CnH2n+2 | CnH2n-2 |
| النشاط الكيميائي | غير نشطة | متوسطة النشاط | الاكثر نشاطا |
| مثال | الميثان | الايثين | الايثاين |
| الذائبية | جميع المركبات الهيدروكربونية لا تذوب في الماء السبب لان الماء المذاب قطبي ( الزيت ) مركب للهيدروكربونيةمذاب غير قطبي و المذابات المشابهة لهما |



