مذكرة الفصل الأول حالات المادة مقرر كيمياء 3
الغازات
الفكرة الرئيسة
تتمدد الغازات و تنتشر كما أنها قابلة للانضغاط لانها ذات كثافة منخفضة و تتكون من جسيمات صغيرة جدا دائمة الحركة
تصف نظرية الحركة الجزيئية سلوك المادة بالاعتماد على حركة جسيماتها ولقد وضع هذا النموذج عدة افتراضات حول حجم جسيمات الغاز و حركتها و طاقتها
فروض النظرية
1- حجم الجسيمات : تتكون الغازات من جسيمات ذات حجوم صغيرة جدا مقارنة بحجوم الفراغات التي تفضل بينها كما أنها متباعدة لذلك تنعدم قوى التجاذب و التنافر فيما بينها
2- حركة الجسيمات : إن حركة جسيمات الغاز مستمرة و عشوائية و تتحرك في خط مستقيم حتى تنصطدم بجسيمات أخرى أو بجدار الوعاء الذي توجد فيه
3- طاقة الجسيمات : هناك عاملان يحددان الطاقة الحركية للجسيم هما : كتلة الجسيم و سرعته و يمكن التعبير عن الطاقة الحركية للجسيم بالعلاقة الآتية :
EK=½mv2
KE : الطاقة الحركية
m : كتلة الجسيم
v : سرعة الجسيم المتجهة
تفسير سلوك الغاز
| الظاهرة | التفسير |
| ان الغاز يملأ الوعاء الذي يوضع فيه | نظرا للحركة العشوائية والدائمه للغاز في كل إتجاه في الوعاء |
| أن الغاز قابل للإنضغاط والتمدد | نظرا للفراغات الكبيرة الموجودة بين جزيئات الغاز |
| أن الغاز قابل للإنتشار والتمدد | نظرا لعدم وجود قوى تجاذب بين الجزيئات |
الانتشار والتدفق
الإنتشار : هو إنتشار الغازات في بعضها البعض بحيث يملأ المساحة بشكل متساوي التدفق حركة الجزيئات من خالل الثقوب الصغير من الضغط العالي للمنخفظ
قانون جراهام : للتدفق ينص على أم معدل سرعة تدفق الغاز يتناسب تناسبا عكسيا مع الجذر التربيعي للكتلة المولية
قانون جراهام : 1/الكتلة المولية √ a
مسائل تدريبية
1- احسب نسبة معدل التدفق لكل من النتروجين N2 و النيون Ne
(( N =14 / Ne =20 الكتل الذرية ))
الجواب :
2- احسب نسبة معدل الانتشار لكل من أول اكسيد الكربون و ثاني اكسيد الكربون (( C =12 / O = 16 الكتل الذرية )
الجواب :
ضغط الغاز
الضغط :
ضغط الهواء ( الضغط الجوي ) :
ضغط الهواء في الأماكن المرتفعة أقل مماهو عند مستوى سطح الأرض( علل العبارة)
| العالم الإيطالي تورشلي 1608م | |
| البارومتر | |
| الماتو متر |
وحدات قياس الضغط
الجدول : مقارنة بين وحدات قياس الضغط
قانون دالتون للضغوط الجزئية
قانون دالتون للضغوط الجزئية P=P1+P2+P3+……Pn |
| الضغط الجزئي للغاز : إذا كان الضغط الكلي لخليط من الغازات مكونا من الاكسجين O2 وثاني اكسيد الكربونCo2 و النتروجين N2 يساوي 0.97atm فاحسب الضغط الجزئي للأكسجين علما بأن الضغط الجزئي لثاني اكسيد الكربون 0.70atm وللنتروجين 0.12atm |
Po2=0.97atm-0.97atm-0.12atm Po2=0.15atm | P total=Pn2+Pco2+Po2 P o2=Pn2 - Pco2 - PN2
|
مسائل تدريبية
احسب الضغط الجزئي لغاز اليدروجين في خليط من غاز الهيليوم و غاز الهيدروجين علما بأن الضغط الكلي 600mmHg و الضغط الجزئي للهيليوم يساوي 439mmHg
الجواب :
قوى التجاذب
الفكرة الرئيسة
تحدد القوى بين الجزيئية ومنها قوى التشتت و القوى الثنائية القطبية و الروابط الهيدروجينة . حالة المادة عند درجة حرارة معينة
تنقسم إلى
1 -قوى الترابط الجزيئية وهي روابط داخلية في الجزيئات , انواعها
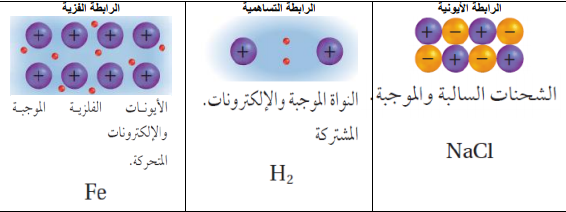
2 -قوى الترابط بين الجزيئية وهي قوى بين الجزيئات تنقسم إلى
قوى التشتت (قوى لندن) توجد بين الجسيمات كافة وهي ضعيفة وتزداد بزيادة حجم الجسيم وعدد الإلكترونات وهي قوى ضعيفة تتكون عندما تتقارب الجسيمات من بعضها حيث حيث تتكون قطبية ثنائية مؤقتة ناتجة من تنافر الإلكترونات وهذا يفسر وجود الفلو والكلور في الحالة الغازية والبروم سائل واليود صلب | الثنائية القطبية وهي تتكون بين الجزيئات دائمة القطبية جزيئات تساهمية تحتوي على عنصر عالي ( F/O/N/Cl/Br ) مثل الكهربية السالبية في حيث تم التجاذب بين الجزيئات امثلة ( HCl/HBr ) هذه المركبات تحتوي قوى التشتت وقوى الثنائية القطبية | الرابطة الهيدروجينية وهي رابطة قوية توجد بين الجزيئات التساهمية عالية القطبية تحتوى على عنصر عالي جدا في السالبية الكهربية مثل ( N/O/F ) وتحتوي على هيدروجين مثل تتكون حيث H-F/H2O/NH3 مركبات الرابطة بين العنصر العالي في السالبية في جزئ وعنصر الهيدروجين في جزيء آخر انظر الكتاب |
السؤال : مقارنة بين الروابط الكيميائية و الفيزيائية
| التسلسل | قوى الترابط البين جزيئية | قوى الترابط الجزيئية |
| 1 | تنشأ بين ( جزيء + جزيء , ذرة + ذرة , جزيء + ذرة , أيون+جزيء.. ) | تنشأ بين ذرة وأخرى لتكوين جزيء مركب |
| 2 | روابط فيزيائية لا يؤدي نشوءها إلا إلى تغير فيزيائي في خواص المادة ولا يؤدي إلى تغير كيميائي | يؤدي نشوءها إلى تحويل الذرات إلى مواد أخرى ذات طبيعة كيميائية مختلفة |
| 3 | تعتبر طاقة هذه الروابط منخفضة | تعتبر طاقة هذه الروابط عالية . |
السؤال : رتب العناصر التالية تصاعديا من ( الأقل إلى الأعلى ) حسب قوة الرابطة البين جزيئية ( قوى التشتت ) مع ذكر السبب
| I2 | Br2 | Cl2 | F2 |
المواد السائلة و المواد الصلبة
الفكرة الرئيسة
لجسيمات المواد الصلبة و السائلة قدرة محدودة على الحركة كما يصعب ضغطها بسهولة
السؤال : الفرق الرئيسي بين الغازات والسوائل يختصر في المسافة الفاصلة بين الجزيئات والتي تمتاز بأنها صغيرة جداً في السوائل وهذا يعني أن ؟
الجواب :
1 -قوى التجاذب بين جزيئات السائل أعلى منها مقارنة بالحالة الغازية .
2 -الانتشار أقل من الحالة الغازية .
3 -ليس له قابليه للانضغاط .
4 -تشترك مع الغازات في الانسيابية , و توصفان معا بالحالة المائعة.
السائل : يتكون من جسيمات دقيقة دائمة الحركة , و هذه الجسيمات عبارة عن جزيئات , فيما عدا الالكتروليتات السائلة كصهير كلوريد الصوديوم حيث تكون عبارة عن أيونات مشحونة بشحنات سالبة و موجبة.
5 -تكون السوائل اكثر كثافة من الغازات ويرجع ذلك قوى التجاذب البين جزيئية التي تربط الجزيئات معا
6 -السوائل لها حجم ثابت وهي لاتتمدد لتملا الوعاة الذي توضع فيه
| الميوعة | |
| اللزوجة | هي مدى مقاومة السائل للانسياب " |
| العوامل التي تؤثر في اللزوجة | 1 -تعتمد على : قوى التجاذب بين جزيئات السائل وتتناسب طردياً معها. 2 -درجة الحرارة : و يتناسب عكسيا معها. 3 -حجم وشكل الجزيئات : تتناسب طرديا معها. فالجزيئات الكبيرة لها لزوجة عالية لأنها تعيق الحركة. |
التوتر السطحي
من خواص السوائل التي تلعب دورا هاما في كثير من الظواهر المعروفة
1 -قوى التجاذب بين جزيئات السائل .
2 -خاصية الميوعة أو االنسياب
و تختلف السوائل فيما بينها في تلك الخواص
. السؤال : العلم الذي يدرس هاتين الخاصيتين هو :
الجواب : ( علم الانسيابية ) حيث يشرح ظاهرتين
التوتر السطحي : تعتمد دراسة التوتر السطحي على قوى التجاذب بين جزيئات السائل .
اللزوجة : تعتمد على خاصية الانسياب.
أولا: التوتر السطحي
السؤال : لماذا يحدث التوتر السطحي ؟
جميع جزيئات السائل تمتاز بقوى تجاذب قوية وفعاله .
جزيئات السائل السطحية تعاني من قوى تجاذب في جميع الاتجاهات عدا الاتجاه إلى أعلى
محصلة القوى تقود إلى جذب هذه الجزيئات السطحية باتجاه وسط ( مركز) السائل تعاني جزيئات السائل السطحية من قوتان تؤثران عليها و هي
1 -قوى جذب جزيئات السائل إلى الداخل نحو المركز فتقل مساحة سطح السائل نتيجة لذلك
2- قوة معاكسة في الاتجاه لزيادة مساحة سطح السائل و منعه من الانكماش.
( و محصلة هذه القوى التي تقود إلى جذب الجزيئات باتجاه وسط السائل تعرف بالتوتر السطحي )
مثال :
قطرات السائل المتساقطة تكون كروية ( حيث أن الشكل الكروي هو أقل الاشكال • الاخرى مساحة سطحية لكل وحدة الحجوم( نتيجة محصلة القوى لجذب جزيئات السائل • نحو المركز والوصول إلى حدوث انخفاض في مساحة سطح السائل, والقوة المعاكسة • لمحاولة زيادة السطح تمنعه من الانكماش. زيادة المساحة السطحية تستدعي صرف طاقة وهي التوتر السطحي
السؤال : تعريف التوتر السطحي
الجواب : هو مقدار الشغل المبذول ( أو الطاقة اللازمة ) لزيادة سطح كمية معينة من سائل ما بمقدار وحدة المساحات .
وهذه الطاقة تتناسب عكسياً مع درجة الحرارة إذ يقل التوتر السطحي بزيادة درجة
حرارة السائل
السؤال : التوتر السطحي يوضح ظاهرتين ؟
1 -ارتفاع السائل في الأنابيب الشعرية و ( هي الخاصية الشعرية ).
2 -ظاهرة التقعر و التحدب على سطح السائل
الخاصية الشعرية
السبب في ارتفاع الماء تلقائياً في أنبوبة شعرية مغمورة في إناء يحتوي على ماء ويأخذ شكل التقعر وانخفاض الزئبق تلقائياً في أنبوبة شعرية مغمورة في إناء يحتوي على زئبق ويأخذ شكل التحدب .
يعرف بالخاصية الشعرية :
تنشأ قوى تجاذب بين جزيئات الماء والزجاج ويسمى ( قوى تلاصق ) لأنها بين جزيئات مادتين مختلفتين ( بين الماء والزجاج ) فهي أقوى من قوى التجاذب بين جزيئات الماء السائل والتي تسمى هن ا( بقوى التماسك) لأنها بين جزيئات نفس المادة . و لهذا يرتفع الماء ملاصقا لجدران الأنبوبة الشعرية.
يتناسب ارتفاع الماء مع قطر الأنبوبة .
قوى التماسك بين جزيئات الزئبق أقوى من قوى التلاصق بينهما و بين الزجاج لذلك يحدث التحدب و انخفاض السائل.




