مذكرة الفصل الثالث سرعة التفاعلات الكيميائية مقرر كيمياء 3
نموذج لسرعة التفاعلات الكيميائية
الفكرة العامة
نظرية التصادم هي المفتاح لفهم الاختلاف في سرعة التفاعلات
التعبير عن سرعة التفاعل
| تتحول المواد المتفاعلة مع مرور الزمن إلى مواد ناتجة ويمكن التعبير عن سرعة التفاعل الكيميائي بالتغير في عدد مولات المواد الناتجة أو المتفاعلة خلال فترة محددة ( أنظر شكل 2-3) |
متوسط السرعة = التغير في كمية المادة المتفاعلة أو الناتجة / التغير في الزمن Δ t
يمكن حساب متوسط سرعة التفاعل الكيميائي بمعدل إستهلاك المواد المتفاعلة أو بمعدل تكون المواد الناتجة خلال فترة محددة
لنفترض أنك ترغب في التعبير عن متوسط سرعة التفاعل التالي خلال فترو زمينة بدأت عند t1 و انتهت عند t2
CO(g)+NO2(g) -----CO2(g) + NO(g)
متوسط سرعة التفاعل [ التركيز النهائي] - [ التركيز الإبتدائي] ÷ الزمن النهائي- الزمن الإبتدائي |
ΔCO/Δt COt2-COt1/t2-t1 تركيز المواد المتفاعلة مع الزمن يتناقص فعند حساب متوسط سرعة التفاعل بإستخدام مادة متفاعلة فإن سرعة التفاعل تكون سالبة ولتلافي ذلك يتم وضع إشارة سالبة في القانون
| ∆ [CO2] / ∆t CO2t2-CO2t2/t2-t1 تركيز المواد الناتجة مع الزمن يزداد |
نظرية التصادم
CO(g) +NO2(g)-----CO2(g)+NO)(g)
فروض نظرية التصادم
| 1 -التصادم بين الجزيئات شرط لحدوث التفاعل أنظر الشكل 3-3 ص 9 | 2 -أن تتخذ الجزيئات المتصادمة أوضاع مناسبة انظر الشكل 4-3 ص 9 |
| 3 -يجب أن تتوفرفي الجزيئات المتصادمة طاقة ) طاقة التنشيط ( لكي تحول المتفاعلات إلى المركب المنشط ومن ثم النواتج انظر الشكل 5-3 ص 9 |
| طاقة التنشيط ( المنشطة ) Ea | لحد الأدنى من الطاقة التي يجب أن تتوفر في الجزيئات المتصادمة لكي تعطي المركب المنشط ومن ثم تكون النواتج |
| علاقة طاقة التنشيط بسرعة التفاعل | كلما كانت طاقة التنشيط عالية قلت سرعة التفاعل ( علاقة عكسية ) |
الرسم البياني يبن 1 -التفاعل طارد للحرارة ( مستوى النواتج أقل من المتفاعلات ) 2 -المعقد المنشط ( حالة وسطية بين المتفاعلات والنواتج قد يؤدي إلى تكوين النواتج أو يتفكك ويعطي المتفاعالت 3- ∆H | 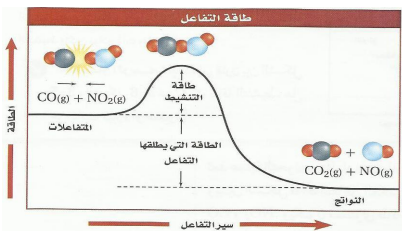 |
الرسم البياني يبن 1 -التفاعل ماص للحرارة ( مستوى النواتج أعلى من المتفاعلات 2 -التفاعل الماص يحتاج طاقة تنشيط أعلى من التفاعل الطارد للحرارة | 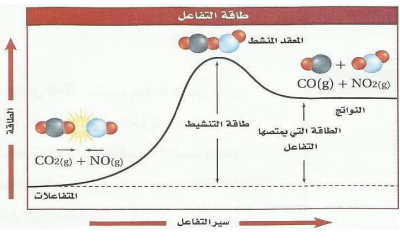 |
العوامل المؤثرة في سرعة التفاعل
الفكرة العامة
تؤثر عوامل كثيرة في سرعة التفاعلات الكيميائية منها طبيعة المواد المتفاعلة و التركيز و درجة الحرارة و مساحة السطح و المحفزات
1- طبيعة المواد المتفاعلة :
تفاعل فلز النحاس Cu مع محلول نترات الفضة AgNO3(g)تركيز M 05.0 حيث تترسب الفضة Ag ويتكون محلول نترات النحاس .
تفاعل فلز الخارصين Zn مع محلول نترات الفضة NO3 Ag تركيز M 05.0 حيث تترسب الفضة Ag ويتكون محلول نترات الخارصين .
وجد بالتجربة أن كمية الفضة المترسبة في التفاعل الثاني أكثر من التفاعل الأول وأن التفاعل الثاني أسرع من الأول ويرجع ذلك إلى أن النحاس يختلف الخارصين وأن الخارصين أنشط من النحاس
2- التركيز
أ- في التفاعلات المتجانسة ( سائل مع سائل أو غاز مع غاز ) تزداد عموما سرعة التفاعل بزيادة التركيز :
لأن التركيز يزيد من عدد التصادمات بين الجزيئات وبالتالي سرعة التفاعل
ب- في التفاعلات غير المتجانسة : ( غاز مع صلب ) وفيها تزداد سرعة التفاعل بزيادة مساحة السطح( منطقة التلامس بين الغاز والسطح )
السؤال : أي التفاعلين أسرع مع تفسير ذلك :
أ- إحتراق قطعة من الخشب وأخرى مماثلة ولكن في صورة نشارة .
ب- صدأ قطعة من الحديد وأخرى مماثلة ولكن في صورة برادة حديد .
3 -درجة الحرارة : عموما تزداد سرعة التفاعل بزيادة درجة الحرارة ( لأن زيادة درجة الحرارة تزيد من الطاقة الحركية للجزيئات وبالتالي زيادة عدد الجزيئات التي تملك الطاقة المنشطة اللازمة لحدوث التفاعل ) | 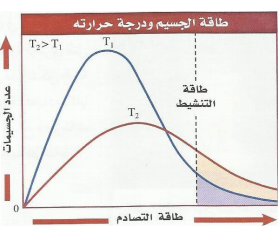 |
4 -المحفزات والمثبطات : أ- المحفزات : ( وجودها يزيد من سرعة التفاعل الكيميائي لإنها تقلل من الطاقة المنشطة التي يحتاجها التفاعل )منها الأنزيمات التي تعمل على زيادة سرعة التفاعل دون أن تستهلك فيه. ب- المثبطات:وهي تعمل عكس عمل المحفز حيث تقلل من سرعة التفاعل الكيميائي )لأنها تزيد من الطاقة المنشطة التي يحتاجها التفاعل( تستخدم المثبطات في صناعة الأغذية تحت مسمى المواد الحافظة أو المواد المضادة للألكسدة ومنها ماهو آمن . حيث تطيل فترة الصالحية للغذاء | 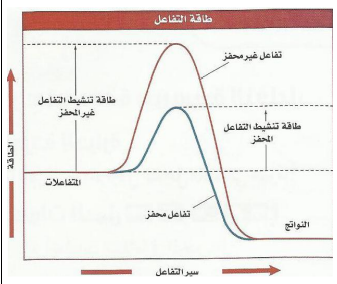 |
السؤال : علل يحترق السكر في جسم اإلنسان عند 33درجة مئوية بينما يحتاج إلى درجة حرارة عالية خارج ذلك ؟
الجواب :
السؤال : أنظر الشكل 11-3 ومن خالله بين العلاقة بين وجود المحفز وطاقة التنشيط ؟
الجواب :
السؤال : فسر سبب تفاعل فلز الماغنيسيوم مع حمض الكلور أسرع من فلز الحديد
الجواب :
السؤال : صف تأثير طحن إحدى المواد المتفاعلة على شكل مسحوق بدلامن وضعها قطعة واحدة في سرعة التفاعل ؟
الجواب :
السؤال : كيف تفسر نظرية التصادم تاثير التركيز في سرعة التفاعل ؟
الجواب :
السؤال : ما دور نشاط المواد المتفاعلة في تحديد سرعة التفاعل الكيميائي ؟
الجواب :
السؤال : طبق نظرية التصادم لتفسير فساد الطعام ببطء عند وضعه في الثلاجة بالمقارنة مع بقائه خارجها عند درجة حرارة الغرفة ؟
الجواب :
السؤال : يتحلل فوق أكسيد الهيدروجين إلى ماء وغاز الأكسجين بسرعة أكبر عند إضافة ثاني أكسيد المنجنيز. إشرح دور ثاني أكسيد المنجنيز في هذا التفاعل إذا علمت أنه لا يستهلك في التفاعل ؟
الجواب :
قوانين سرعة التفاعل
الفكرة الرئيسة
قانون سرعة التفاعل عبارة عن علاقة رياضية يمكن تحديدها بالتجربة تربط بين سرعة التفاعل و تركيز المادة المتفاعلة
كتابة قوانين سرعة التفاعلات ؟
قانون سرعة التفاعل يعبر
عن العلاقة بين سرعة التفاعل الكيميائي و تركيز المواد المتفاعلة . فعلى سبيل المثال يعد التفاعل A---Bتفاعلا من خطوة واحدة و يعبر عن قانون سرعة تفاعله على النحو التالي :
(A)R=K R يمثل شرعة التفاعل (A) تركيز المادة المتفاعلة بينما K هو ثابت سرعة التفاعل يعبر عن سرعة التفاعل بخطوة واحدة بحاصل ضرب كمية ثابتة في تركيز المادة المتفاعلة |
تحدده الخطوة البطيئة
أ- ب- ج- | مثال ( 1) إذا كان تفاعل ما يمر بالخطوات التالية : بطيئة خطوة H2 + 2NO N2O + H2O سريعة خطوة H2 + N2O N2 + H2O أ- أكتب قانون سرعة التفاعل لهذا التفاعل . ب- حدد رتبة التفاعل بالنسبة لـ NO وبالنسبة لـ H2. ج- حدد الرتبة الكلية للتفاعل |
أ- ب- | مثال( 2 ) إذا كان التفاعل التالي يمر بالخطوات التالية بطيئة خطوة O3 O2 + O سريعة خطوة NO + O NO2 أ- أكتب قانون سرعة التفاعل ب- حدد رتبة التفاعل . |
السؤال : طبق اكتب معادلات قانون سرعة التفاعل التي تظهر الفرق بين التفاعل من الرتبة الأولى و التفاعل من التفاعل من الرتبة الثانية لمادة منفاعلة واحدة ؟
الجواب :




