مذكرة الفصل الثاني المخاليط والمحاليل مقرر كيمياء 4
المخلوط : هو مزيج من مادتين أو اكثر بحيث تحتفظ فيه كل مادة بخصائصها الكيميائية
السؤال : أنواع المخاليط ؟
الجواب : مخاليط غير متجانسة - المخاليط المتجانسة
المخاليط غير المتجانسة هي المخاليط التي لا تمتزج مكوناتها تماما معا , أي يمكن تمييز كل منها وهي تنقسم إلى نوعين هما المعلق والغروي
| المخلوط المعلق ( انظر الشكل في الكتاب صـ46 ) | المخلوط الغروي ( انظر الشكل 2-2صـ47 ) |
| مخلوط يحتوي على جسيمات يمكن أن تترسب بالترويق إذا ترك فترة دون تحريك , وعند تمرير المخلوط المعلق خلال ورقة ترشيح تفصل الجسيمات المعلقة حجوم جسيمات المخلوط المعلق أكبر من حجوم الذرات لذلك تترسب في المخلوط | مخلوط يتكون من جسيمات متوسطة الحجم بحيث أنها التترسب في المخلوط , ولا يمكن فصل مكوناته بالترويق أو الترشيح ويعد الحليب مخلوطا غرويا |
السؤال : المذيب ؟
الجواب : المادة الأكثر توافرا في المخلوط
السؤال : من أسباب عدم ترسب جسيمات المذاب في المخلوط الغروي؟
الجواب : تكون طبقات كهروسكونية حول الجسيمات تعمل على تنافر المذاب( الجسيمات)عن المذيب
السؤال : الحركة البراونية ؟
الجواب : وهي الحركة العشوائية لجسيمات المذاب في المخلوط الغروي
السؤال : تنتج الحركة البراونية؟
الجواب : عن تصادم جسيمات المذيب مع جسيمات المذاب بحيث تمنع هذه التصادمات جسيمات المذاب من الترسب في المخلوط
ظاهرة تندال
يظهر الشكل 3-1 مرور حزمة من الضوء من خلال مخلوطين مجهولين. ويمكنك ملاحظة كيف تعمل جسيمات المذاب في المخلوط الغروي على تشتيت الضوء على خالف جسيمات المحلول وتظهر المخاليط المعلقة أيضا تأثير تندال .أما المحاليل فلا يمكن أن تظهر هذه الظاهرة يمكنك ملاحظة تأثير عندما تشاهد مرور أشعة الشمس خلال الهواء المشبع بالدخان , أو مرور ضوء خلال الضباب
السؤال : المخاليط المتجانسة ؟
الجواب :
هي محاليل متجانسة تحتوي على مادتين أو أكثر . تسمى المذاب والمذيب , المذاب هو المادة التي تذوب , والمذيب هو الوسط الذي يذيب المذاب , و لا يمكن التمييز بين المذاب والمذيب عند النظر إلى المحلول
تركيز المحاليل
التعبير عن التركيز
| التركيز : |
| التعبير الوصفي عن التركيز : |
غالبا ما يتم التعبير عن تركيز المحاليل كميا ، ومن أكثر التعابير الكمية عن التركيز شيوعا ما يوضحه الجدول التالي : طرق التعبير عن تركيز المحاليل
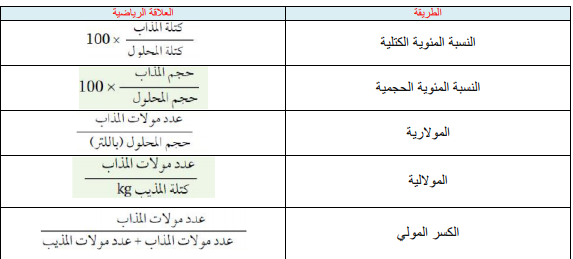
النسبة المئوية بالكتلة :
النسبة المئوية بالكتلة : كتلة المذاب / كتلة المحلول ×100
السؤال : حساب النسبة المئوية بالكتلة للمحافظة على تركيز كلوريد الصوديومNaCL في حوض الأسماك كما هو في ماء البحر يجب أن يحتوي حوض الأسماك على NaCL لكل 100 ماء ما النسبة المئوية بالكتلة لكلوريد الصوديوم في المحلول ؟
| 3.6+100.0=103.6 | كتلة المحلول = كتلة المذيب + كتلة المذاب |
| 3.6/103.6×100=3.5% | النسبة المئوية بالكتلة = كتلة المذاب / كتلة الحلول ×100 |
مسائل تدريبية
ما النسبة المئوية بالحجم للغيثانول في محلول يحتوي على 35ml إيثانون مذاب في 155mlماء ؟
الجواب :
حجم المحلول= حجم المذاب + حجم المذيب
190 ml = 155ml + 35ml
النسبة المئوية الحجمية = 35ml/190ml×100=18.42%
المولارية ( التركيز المولاري )
مامعنى : محلول تركيزه المولاري 0M.1 - محلول تركيزه المولاري 1M.0
المولارية M = عدد مولات المذاب ( mol ) / حجم المحلول L
السؤال : حساب المولارية يحتوي 100.5ml من محلول حقن الوريد على 5.10 غرام من سكر الجلوكوز c6H16O6. ما مولارية هذا المحلول إذ علمت أن الكتلة المولية الجلوكوز هي 180.16g/mol
المعطيات 100.5 ml = حجم المحلول 0.1005 L = 100.5/1000 كتلة المذاب = 10g.5 الكتلة المولية للمذاب =mol/1gl.180 | الكتلة المولية للمذاب / كتلة المذاب بالجرام =عدد مولات المذاب 5.10g/180.1g/mol =0.0283mol |
المعطيات 100.5 ml = حجم المحلول 0.1005 L = 100.5/1000 كتلة المذاب = 10g.5 الكتلة المولية للمذاب =mol/1gl.180 | حجم المحلول باللتر / عدد مولات المذاب = المولارية 0.0283mol/0.1005=0.282m |
المولاية ( التركيز المولالي )
المولاية ( التركيز المولالي ) : يتغير حجم المحلول عند تغير درجة الحرارة إذ يتمدد أو يتقلص مما يؤثر في مولارية المحلول . لكن لا تتأثر كتل المواد في المحلول بدرجات الحرارة لذا من المفيد أحيانا وصف المحاليل بعدد مولات المذاب الموجوجة في كتلة معينة من المذيب . ويسمى مثل هذا الوصف المولالية و يرمز بالركز m وهي نسبة عدد مولات المذاب الذائبة 1kgمن المذيب و يكون تركيز المحلول الذي يحتوي على 1 mol من المذاب في 1 kg من المذيب 1m ( 1 محلول مولالى )
المولالية m = عدد مولات المذاب / كتلة المذيب kg
مثال 4-1
حسب المولالية أضاف طالب في إحدى التجارب 4.5 g من كلوريد الصوديوم إلى 100.0g احسب مولالية المحلول :
الجواب :
المعطيات 4.5g = NaCl المذاب كتلة كتلة المذيب = (1000/100) 0.1 kg المطلوب التركيز ( المولالية) Cl= 35.453 / Na = 23 (الذرية الكتل ) | نحسب عدد مولات المذاب = كتلة المذاب بالجرام على الكتلة الموليةNaCl 4.5 g /(23+35.453) = 0.077 mo نحسب التركيز بالمولالية 0.077mol / 0.1kg =0.77 m(molal) |
السؤال : تحد ما كتلة Ba(OH)2 بالجرامات اللازمة لتحضير محلول مائي 1.00m
الجواب :
الكتل الذرية Ba=137.327 / O=16 / H= 1 عدد مولات المذاب= 1mol كتلة المذيب = kg 1 | الكتلة المولية = 137.327+(16+1)×2=171.327g/mol كتلة المذاب = عدد المولات x الكتلة المولية 171.327g = 171.327 x 1 |
الكسر المولي ( الكسر الجزيئي )
السؤال : تعريف الكسر المولي :
الجواب : هو النسبة بين عدد مولات أحد مكونات المحلول ( n ) إلى مجموع مولات كل مكوناته ( nt . ) وبفرض أن لدينا ثلاثة مواد ( C , B , A ) وعدد مولات هذه المواد ( C n , B n , A n ) فإن الكسر المولي للمواد هو :
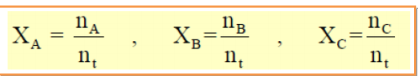
ومجموع الكسور المولية يساوي دائما الواحد الصحيح :

س29ص59 ما الكسر المولي لـ NaOH في محلول مائي منه يحتوي على 22.8% وزنا من NaOH ( O=16,H=1,Na= 23 ) | س30ص59 إذا كان الكسر المولي لحمض الكبريت H2SO4 في محلول مائي هو 5.0 فما كتلة الماء الموجودة في 100ml من المحلول ( O=16,H=1,S=32 ) |
نفرض أن كتلة المحلول 100 g إذا كتلة NaOH 22.8g وكتلة الماء = كتلة المحلول - كتلة المذاب 100 - 22.8 = 77.2 g الكتلة المولية لـ( H2O ) ( 1 × 2 ) + ( 1 × 16 ) = 18 g/mol لكتلة المولية لـ NaOH ( 23 × 1 ) +( 16 × 1 ) + ( 1 × 1 ) = 40g/mol عدد المولات = الكتلة ÷ الكتلة المولي إذا عدد مولات = H2O 77.2 ÷ 18 = 4.28mol عدد مولات= NaOH 22.8 ÷ 40 = 0.57mol مجموع عدد المولات = 4.28 +0.57=4.85mol | نفرض أن n H2O + n H2SO4 = 1mol n H2SO4 / n H2O + n H2SO4 =0.325 n H2SO4 / 1 = 0.325 إذا عدد مولات حمض الكبريتيك أو H2SO4 n 0.325mol 1 - 0.325 = 0.675mol الماء مولات عدد كتلة المذاب H2SO4( = عددمولاته) × ( الكتلة المولية) = 0.325g × (4×10+32+2×1)g/mo = 31.85g كتلة المذيب H2O = عدد مولاته × الكتلة المولية = 0.675mol × (16+ 2×1)g/mo = 12.15g كتلة المحلول = كتلة المذاب + كتلة المذيب |
الكسر المولي لـ NaOH = 0.57 / 4.85= 0.11 | = 31.85 + 12.15 =44g النسبة المئوية الكتلية للمذاب = كتلة المذاب ÷ كتلة المحلول × 100 = 31.85g / 44g × 100=72.39% النسبة المئوية الكتلية للمذيب = 100 % - 72.39% = 27.6% كتلة الماء في 100g ماء = g 6.27 |
.




