ملخص كيمياء 3 ثانوي مقررات أ. هادي المالكي
الفصل الأول : حالات المادة
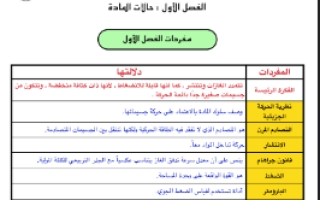
مفردات الفصل الأول
| المفردات | دلالتها |
| الفكرة الرئيسة | تتمدد الغازات و تنتشر كما انها قابلة للانضغاط لأنها ذات كثافة منخفضة و تتكون من جسيمات صغيرة جدا دائمة الحركة |
| نظرية الحركة الجزيئية | وصف سلوك المادة بالاعتماد على حركة جسيماتها |
| التصادم المرن | هو التصادم الذي لا تفقد فيه الطاقة الحركية ولكنها تنتقل بين الجسيمات المتصادمة. |
| الانتشار | حركة تداخل المواد معا |
| قانون جراهام | ينص على أن معدل سرعة تدفق الغاز يتناسب عكسيا مع الجذر التربيعي للكتلة المولية |
| الضغط | هو القوة الواقعة على وحدة المساحة. |
| البارومتر | أداة تستخدم لقياس الضغط الجوي. |
| المانومتر | أداة تستخدم لقياس ضغط الغاز المحصور. |
1- باسكال 2- لبضغط الجوي 3- قانون دالتون للضغوط الجزيئية | مقدار قوة واحد نيوتن لكل متر مربع. وحدة قياس ضغط الهواء. ينص على إن الضغط الكلي لخليط من الغاز يساوي مجموع الضغوط الجزئية للغازات الكونة له. للضغوط الجزيئية |
| الفكرة الرئيسة | تحدد القوى بي الجزيئات - ومنها قوى التشتت ، والقوى الثنائية القطبية ، والروابط الهيدروجينية - حالة الادة عند درجة حرارة معينة . |
| قوى التشتت | قوى تجاذب ضعيفة تنشأ بين الجزيئات غير القطبية، وتعرف بقوى "لندن" |
| القوى الثنائية القطبية | قوة التجاذب بين مناطق مختلفة الشحنة في الجزيئات القطبية |
| الرابطة الهيدروجينية | رابطة تنشأ بي الجزيئات التي تحتوي ذرات هيدروجين متحدة بذرات ذات كهروسالبية عالية كالفلور والاكسجين والنيتروجين |
الفصل الأول : حالات المادة
تابع مفردات الفصل الأول
| المفردات | دلالتها |
| الفكرة الرئيسة | لجسيمات الواد الصلبة والسائلة قدرة محدودة على الحركة ، كما يصعب ضغطها بسهولة. |
| اللزوجة | هي مقياس مقاومة السائل للتدفق والانسياب. |
| التوتر السطحي | هو الطاقة الازمة لزيادة مساحة سطح السائل بمقدار معين |
| عوامل خافضة | هي المركبات التي تعمل على خفض التوتر السطحي للماء. |
| المادة الصلبة البلورية | هي المادة ذراتها أو أيوناتها أو جزيئاتها مرتبة في شكل هندسي منتظم |
| وحدة البناء | هي أصغر ترتيب للذرات في الشبكة البلورية يحمل التماثل نفسه. |
| التأصل | هو ظاهرة وجود عنصر مثل الكربون بثلاثة أشكال في الحالة الفيزيائية نفسها (صلبة أو سائلة أو غازية ) |
| المواد الصلبة غير المتبلورة | هي المواد التي لا تترتب فيها الجسيمات بنمط مكرر ومنتظم ولا تحتوي على بلورات. التبلورة |
| الفكرة الرئيسة | تتغير حالة المادة عند إضافة الطاقة إليها أو انتزاعها منها . |
| درجة الانصهار | هي درجة الحرارة التي تتكسر عندها القوى التي تربط جسيمات الشبكة البلورية بعضها ببعض، فتتحول المادة إلى الحالة السائلة. |
| التبخر | هو العملية التي يتحول من خلالها السائل الى غاز او بخار |
| التبخر السطحي | عندما يحدث التبخر عند سطح السائل فقط. |
| ضغط البخار | الضغط الناشئ عن البخار فوق سطح السائل. |
| درجة الغليان | درجة الحرارة التي يتساوى عندها ضغط بخار السائل مع الضغط الخارجي او الضغط الجوي. |
| درجة التجمد | درجة الحرارة التي يتحول عندها السائل الى صلب بلوري. |
| التكاثف | عملية تحول البخار الى سائل. |
| الترسب | عملية تحول الادة من الحالة الغازية الى الحالة الصلبة دون المرور بالحالة السائلة، وهو عكس التسامي. |
| مخطط الحالة الفيزيائية ( الطور ) | رسم بياني للضغط مقابل درجة الحرارة يوضح حالة المادة تحت ظروف مختلفة من درجة الحرارة والضغط. |
| النقطة الثلاثية | نقطة على الرسم البياني تمثل درجة الحرارة والضغط حيث يوجد عندها الماء في حالته الثلاث معا. |
| النقطة الحرجة | هي النقطة التي تمثل كلا من الضغط و درجة الحرارة التي لا يمكن للماء بعدها ان يكون في الحالة السائلة |
الفصل الأول : حالات المادة
أهم تطبيقات الفصل الأول
| المواد و العمليات | التطبيقات و الاستخدامات و الأمثلة |
| قوى التجاذب داخل الجزيئات | الرابطة الايونية ، الرابطة التساهمية ،الرابطة الفزية . |
| قوى التجاذب بين الجزيئات | قوى التشتت ( قوى لندن) ، قوى ثنائية القطبية ، الروابط الهيدروجينية |
| الانضغاط والتمدد | عصر وسادة البوليسترين بالضغط عليها ثم التوقف عن ضغطها فتبدأ بالتمدد. |
| الانتشار و التدفق | انتشار الروائح كالعطور ورائحة الطبخ. تدفق الغاز من ثقب كالبالون أو إطار السيارات. |
| المـيوعـة | انـــــسياب الـــسوائـــل وانــــــتشار الــــــغازات |
| اللزوجة | إخراج العسل من القارورة . الجليسرول مادة لزجة تستخدم في التشحيم. عوامل تؤثر في اللزوجة : قوى التجاذب-حجم الجسيمات وشكلها -درجة الحرارة. |
| التوتر السطحي | سير العنكبوت فوق سطح ماء البركة . |
| التآصل | مثال / الألماس ، والجرافيت ، والبكمنستر فوليرين |
| زيادة في الضغط | أحــذيــة الـــكعب الــعالــي |
| الروابط الهيدروجينة | بسببها الماء مركب استثنائي فالجليد ذو كثافة أقل فيطفو فوق السائل . ودرجة غليان الماء أعلى من الركبات المشابهة له في الكتلة . |
| التماسك و التلاصق | في المخبار المدرج الماء هلالي الشكل (التلاصق أقوى) والزئبق محدب ( التماسكك أقوى). |
| المواد الصلبة الذرية | مثالها : الغازات النبيلة عند تجمدها |
| المواد الصلبة الجزيئية | مثل : السكر ، الثلج |
| المواد الصلبة التساهمية الشبكية | مثل: الكوارتز ، تآصل الكربون ( الألماس -الجرافيت البكمنستر فوليرين). |
| المواد الصلبة الايونية | مثل : ملح الطعام |
| المواد الصلبة الفلزية | مثل: الحديد ، الألمنيوم ، النحاس ، الذهب ، الفضة. |
| المواد الصلبة غير المتبلورة | مثل: الزجاج ، المطاط ، كثير من البلاستيك . |
| الثلج الجاف | يفضل استخدامه لحفظ اللحوم عند الشحن لأنه يتسامى ولا ينصهر كالثلج العادي. |
| 1- تغيرات فيزيائية ماصة للحرارة 2- تغيرات فيزيائية طاردة للحرارة | التبخر - الانصهار - التسامي
التجمد -التكثف - الترسب |
الفصل الأول : حالات المادة
القوانين و العلاقات الرياضية و وحدات القياس “ الفصل الأول ”
| اسم القانون | وحدات القياس و العلاقات الرياضية |
| الكثافة | g/ml |
| الضغط | باسكال ( Pa ) ، رطل ( psi ) ، ملم زئبق ( mmHg ) ، تور ( toor ) بار ( bar ) الضغط الجوي ( atm ) |
| ضغط الهواء | ضغط الاماكن المرتفعة( ضغط جسيماتها أقل) أقل من الضغط عند سطح البحر |
| قانون جراهام يتناسب معدل تدفق أو انتشار الغاز عكسيا مع الجذر التربيعي للكتلة المولية له. | 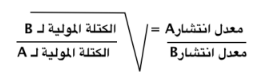 |
| متوسط الطاقة الحركية للغازات | KE = 1/2 mv2 |
| البارومتر | صممه تورشلي وهو أداة تستخدم لقياس الضغط الجوي . |
| المانومتر | أداة تستخدم لقياس الضغط المحصور . |
| للضغوط دالتون قانون الجزئية | Ptotal = P1 + P2 + P3 + ....Pn |
الفصل الثاني : الطاقة و التغيرات الكيميائية
مفردات الفصل الثاني
| المفردات | دلالتها |
| الفكرة الرئيسة | قــد يتغـيـر شـكـل الطـاقـة ، وقـد تنتقـل ، ولكنهـا تبقـى محفوظة دائما. |
| الطاقة | القدرة على بذل شغل أو إنتاج حرارة. |
| قانون حفظ الطاقة | يـنص عـلى إن أي تـفاعـل كـيميائـي أو عـملية فـيزيـائـية يـمكن أن تـتحول الـطاقـة مـن شـكل إلـى آخـر، ولكنها ل تستحدث ول تفنى. |
| طاقة الوضع الكيميائية | هي الطاقة المخزنة في الروابط الكيميائية للمادة |
| الحرارة | هي طاقة تنتقل من الجسم الساخن إلى الجسم البرد. |
| السعر | هي كمية الحرارة اللازمة لرفع درجة واحدة 1g من الماء النقي 1oC. |
| الجول | وحدة قياس الطاقة الحرارية وفق النظام الدولي للوحدات (J (Joule. |
| الحرارة النوعية | هي كمية الحرارة اللازمة لأي مادة لرفع درجة حرارة جرام من تلك الادة درجة سيليزية واحدة. |
| الفكرة الرئيسة | التغير في المحتوى الحراري للتفاعل يساوي المحتـوى الحـراري للنواتـج مطروحـا منه المحتوى الحراري للمواد التفاعلة. |
| المسعر | جهاز معزول حراريا يستخدم لقياس كمية الحرارة الممتصة أو المنطلقة في أثناء عملية كيميائية أو فيزيائية |
| الضغط | القوة الواقعة على وحدة الساحة. |
| الكيمياء الحرارية | تدرس الكيمياء الحرارية تغيرات الحرارة التي ترافق التفاعلات الكيميائية و تغيرات الحالة الفيزيائية. |
| النظام | هو جزء معي من الكون يحتوي على التفاعل او العملية التي تريد دراستها. |
| المحيط | هو كل شي في الكون غير النظام. |
| الكون | (النظام + المحيط) |
| المحتوى الحراري ( H ) | يعرف بأنه مقدار الطاقة الحرارية الخزنة في مول واحد من الماده تحت ضغط ثابت. |
| الحتوى للتفاعل الحراري ( Hrxn ) | المحتوى للتفاعل الحراري ( أو حرارة التفاعل ) هو التغير في المحتوى الحراري |
الفصل الثاني : الطاقة و التغيرات الكيميائية
تابع مفردات الفصل الثاني
| المفردات | دلالتها |
| الفكرة الرئيسة | تعـبر المعـادلات الكيميائيـة الحراريـة عـن مقـدار الحـرارة المنطلقة أو الممتصة في التفاعلات الكيميائية. |
| المعادلة الكيميائية الحرارية | هي معادلة كيميائية موزونة تشتمل على الحالات الفيزيائية لجميع الواد التفاعلة والناتجة والتغير Hrxn في الطاقة والذي يعبر عنه بأنه تغير في المحتوى الحراري |
| حرارة الاحتراق | هو المحتوى الحراري الناتج عن حرق 1 مول من الادة احتراقا كاملا |
| حرارة التبخر المولارية Hvap∆ | الحرارة اللازمة لتبخر 1 مول من السائل |
| حرارة الانصهار المولارية Hfus∆ | الحرارة اللازمة لانصهار 1mol من مادة صلبة |
| الفكرة الرئيسة | يـمـكـن حـســاب التغـير في المحـتوى الحراري للتفاعلات الكيميائية باستعمال قانون هس. |
| قانون هس | ينص على أن حرارة التفاعل أو التغير في المحتوى الحراري تتوقف على طبيعه المواد الداخله في التفاعل و المواد الناتجه منه. |
| حرارة التكوين القياسية Hof∆ | بأنها التغير في المحتوى الحراري الذي يرافق تكوين مول واحد من الركب في الظروف القياسية من عناصره في حالاتها القياسية. |
الفصل الثاني : الطاقة و التغيرات الكيميائية
أهم تطبيقات الفصل الثاني
العمليات و التطبيقات و الاستخدامات و الامثلة
| المواد والعمليات | التطبيقات والاستخدامات والامثلة |
| تفاعل ماص للحرارة | الكمادة الباردة( نظام) + الیدین ( محیط) = الكون |
| تفاعل طارد للحرارة | الكمادة الساخنة ( نظام) +الیدین ( محیط) = الكون مثال آخر : تسخین الجنود لطعامھم في المیدان. |
| الطاقة الشمسیة | الخلایا الكھروضوئیة |
| عملیات فیزیائیة ماصة للحرارة | التبخر + =Hvap ، ∆الانصھار + =Hfus∆ |
| عملیات فیزیائیة طاردة للحرارة | التكثف - =Hcond ∆التجمد - =Hsolid∆ |
| عملیتین متعاكستین | لھما نفس القیمة وتختلف الإشارة التبخر + =Hvap ∆التكثف - =Hcond∆ |
| عملیتین متعاكستین | لھما نفس القیمة وتختلف الإشارة الانصھار + =Hfus ∆التجمد - =Hsolid∆ |
| تفاعلات الاحتراق تعني التفاعل مع الأكسجین O2 | احتراق الغذاء كوقود في الجسم ، احتراق المیثان للتدفئة في البیوت ، احتراق الجازولین كوقود للسفن وللطائرات وللسیارات |
الفصل الثاني : الطاقة و التغيرات الكيميائية
القوانين والعلاقات الرياضية ووحدات القياس الفصل الثاني
| اسم القانون | وحدات القیاس والعلاقات الریاضیة |
| قیاس الحرارة أو الطاقة الحراریة | السعر ( cal ) ، السعر الغذائي ( Cal ) = Kcal الجول( J ) وھو الوحدة الدولیة لقیاس الطاقة الحراریة. 1J= 0.239 cal , 1 cal = 4.184 J |
| وحدة قیاس الحرارة النوعیة | 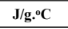 |
| الحرارة كمیة حساب | q=c x m x T |
| للتفاعل الحراري المحتوى ∆Hrxn | Hrxn= Hproducts - Hreactants |
| التفاعل الطارد للحرارة | تكون له قیمة Hrxn ∆سالبة - =Hrxn∆ |
| التفاعل الماص للحرارة | تكون له قیمة Hrxn ∆موجبة + =Hrxn∆ |
| حرارة الاحتراق القیاسیة Hcomb ∆ | ھي : المحتوى الحراري الناتج عن حرق 1mol من المادة حرقا كاملا |
| حرارة التبخر المولاریة Hvap ∆ | ھي : الحرارة اللازمة لتبخیر 1mol من سائل . |
| حرارة الانصھار المولاریة Hfus ∆ | ھي : الحرارة اللازمة لصھر 1mol من مادة صلبة . |
| قانون ھس | یستعمل لحساب التغیر في المحتوى الحراري للتفاعلات الكیمیائیة |
| حرارة التكوین القیاسیة Hof∆ | التغیر في المحتوى الحراري الذي یرافق تكون مول واحد من المركب في الظروف القیاسیة من عناصره في حالاتھا القیاسیة. |
| التجمیع معادلة | Horxn = Σ∆Ho(products) - Σ∆Ho(reactants) ∆ |
الفصل الثالث ( سرعة التفاعلات الكيميائية )
مفردات الفصل الثالث
| المفردات | دلالتها |
| الفكرة الرئيسة | نظرية التصادم هي المفتاح لفهم الاختلاف في سرعة التفاعلات |
| سرعة التفاعل الكيميائي | هو تعبير عن التغير في تركيز الواد التفاعلة أو الناتجة في وحدة الزمن، ويعبر عنها بوحدة mol/L.s |
| نظرية التصادم | تنص على وجوب تصادم الذرات واليونات والجزيئات بعضها ببعض لكي يتم التفاعل. |
| العقد النشط | جسيمات عمرها قصير. |
| طاقة التنشيط | هو الحد الادنى من الطاقة لدى الجزيئات المتفاعلة واللازم لتكوين العقد النشط وإحداث التفاعل. |
| الفكرة الرئيسة | تؤثر عوامل كثيرة في سرعة التفاعل الكيميائي ، منها طبيعة المواد المتفاعلة ، والتركيز ، ودرجة الحرارة ، ومساحة السطح ، والمحفزات |
| المحفزات | مواد تعمل على زيادة سرعة التفاعل الكيميائي. |
| المثبطات | مواد تعمل على إبطاء سرعة التفاعل |
| الفكرة الرئيسة | قانون سرعة التفاعل عبارة عن علاقة رياضية - من تحديدها بالتجربة - تربط بين سرعة التفاعل و تركيز المادة المتفاعلة |
| قانون سرعه التفاعل | هو قانون يعبر عن العلاقة بين سرعة التفاعل الكيميائي وتركيز المواد المتفاعلة فيه. |
| ثابت سرعة التفاعل | قيمة عددية ثابته يرمز لها بالرمز k. |
| رتبة التفاعل | الرقم العلوي الذي يمثل الأس للمادة المتفاعلة المكتوبة في قانون سرعة التفاعل. |
الفصل الثالث ( سرعة التفاعلات الكيميائية )
أهم تطبيقات الفصل الثالث
| المواد و العمليات | التطبيقات و الاستخدامات و الامثلة |
| سرعة التفاعل الكیمیائي | التغیر في تركیز المواد المتفاعلة أو الناتجة في وحدة الزمن |
| نظریة التصادم | یجب حدوث التصادم بین الذرات والأیونات والجزیئات ببعضھا البعض لیحدث التفاعل |
| المعقد النشط | جسیمات عمرھا قصیر ، وتسمى بالحالة الانتقالیة ،وھي حالة غیر مستقرة. |
| طاقة التنشیط | الحد الأدنى من الطاقة الذي یجب وصول الجزیئات المتفاعلة لھ لتكوین المعقد النشط . |
| ملخص نظریة التصادم | 1 -یجب أن تتصادم (ذرات أو أیونات أو جزیئات) المواد المتفاعلة. 3-یجب أن تتصادم المواد المتفاعلة بطاقة كافیة لتكوین المعقد النشط . |
| العوامل المؤثرة في سرعة التفاعل الكیمیائي | 1- طبیعة المواد المتفاعلة 2 -تركیز المواد المتفاعلة 3 -مساحة السطح 4 -درجة الحرارة 5 -المحفزات |
| طبیعة المواد المتفاعلة | تفاعل الخارصینZn مع نترات الفضة أسرع من تفاعل النحاس Cu لأن الخارصین أنشط كیمیائیا من النحاس |
| تركیز المواد المتفاعلة | كلما زاد التركیز كلما زادت التصادمات بین الجسیمات |
| مساحة السطح | احتراق نشارة الخشب أسرع من احتراق لوح خشب لھما نفس الكتلة. صدأ برادة الحدید أسرع من صدأ مكعب حدید لھما نفس الكتلة. |
| مساحة السطح | احتراق نشارة الخشب أسرع من احتراق لوح خشب لھما نفس الكتلة. صدأ برادة الحدید أسرع من صدأ مكعب حدید لھما نفس الكتلة. |
| درجة الحرارة | زیادة درجة الحرارة تزید سرعة التفاعل الكیمیائي . التبرید یقلل من سرعة تفاعلات تحلل وفساد الأطعمة . |
| المحفزات | تزید سرعة التفاعل الكیمیائي دون أن تستھلك ، مثل الأنزیمات في الجسم . |
| المثبطات | تعمل على إبطاء سرعة التفاعل الكیمیائي ، أو إیقاف بعض التفاعلات . مثل : المواد الحافظة في الأطعمة |
الفصل الثالث ( سرعة التفاعلات الكيميائية )
القوانين والعلاقات الرياضية ووحدات القياس الفصل الثالث
| اسم القانون | العلاقات الرياضية و وحدات القياس |
| متوسط سرعة التفاعل الكیمیائي |  |
| تقاس سرعة التفاعل الكیمیائي | 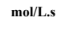 |
| معادلة متوسط سرعة التفاعل |  |
| قانون سرعة التفاعل | [A[K= R قانون سرعة التفاعل لتفاعل یحدث في خطوة واحدة B A |
| التفاعل سرعة ثابت K | بـ يقاس s-1 ، L2/mol2.s ، L/mol.s |
| القانون العام لسرعة التفاعل | R= K[A]m [B]n سرعة التفاعل تساوي حاصل ضرب ثابت سرعة التفاعل في تراكیز المواد المتفاعلة كل منھا یرفع للأس ( الرتبة) التي یتم تحدیدھا تجریبیا |
| رتبة التفاعل | ھي مجموع الرتب لكل مادة متفاعلة ( مجموع الأسس) وتحسب تجریبیا |
الفصل الثالث ( سرعة التفاعلات الكيميائية )
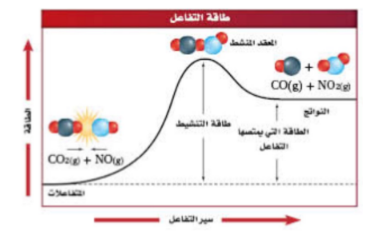 | 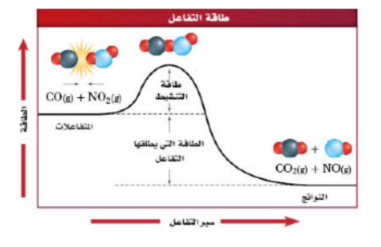 | 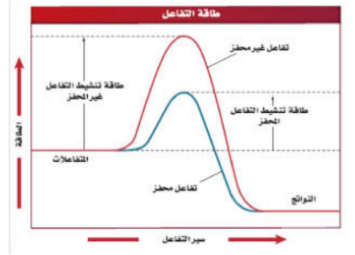 |
| منحنى تفاعل ماص للحرارة | منحنى تفاعل طارد للحرارة | منحنى یوضح تأثیر المحفز على طاقة التنشیط |
الفصل الرابع ( الاتزان الكيميائي )
مفردات الفصل الرابع
| المفردات | دلالتها |
| الفكرة الرئيسة | يوصف الاتزان الكيميائي بتعبير ثابت الاتزان ، الذي يعتمد على تراكيز المواد المتفاعلة والناتجة . |
| التفاعل العكسي | هو التفاعل الكيميائي الذي يحدث في الاتجاهين الأمامي والعكسي. |
| الاتزان الكيميائي | بأنه حالة النظام عندما تتساوي سرعتي التفاعل الامامي والعكسي، وعندها تثبت تراكيز المواد التفاعلة والناتجة. |
| قانون الاتزان الكيميائي | الذي ينص على أنه عند درجة حرارة معينة يمكن للتفاعل الكيميائي أن يصل إلى حالة تصبح فيها نسب تراكيز التفاعلت والنواتج ثابتة. |
| ثابت الاتزان Keq | هو القيمة العددية لنسبة حاصل ضرب ترايز النواتج على حاصل ضرب تراكيز التفاعلات و يرفع كل تركيز إلى أس مساو للمعامل الخاص به في في المعادلة الموزونة |
| اتزان متجانس | وهذا يعني أن التفاعلات والنواتج موجودة في الحالة الفيزيائية نفسها. |
| اتزان فير المتجانس | عندما توجد المتفاعلات و النواتج في أكثر من حالة فيزيائية |
| الفكرة الرئيسة | عندما تطرأ تغييرات على نظام متزن يزاح إلى موضع اتزان جديد |
| مبدأ لوتشاتلييه | إذا بذل جهد على نظام في حالة اتزان فإن ذلك يؤدي إلى إزاحة النظام في اتجاه يخفف أثر هذا الجهد . و الجهد هو أي تاثير يغير في اتزان نظام معي. |
| العوامل المؤثرة على الاتزان الكيمائي | 1- التركيز . 2 -الضغط ( الحجم). 3 -درجة الحرارة . 4 -المواد المحفزة . |
| الفكرة الرئيسة | يمكن استعمال تعبير ثابت التزان في حساب تراكيز المواد في التفاعل وذوبانيتها |
| ثابت حاصل الذائبية | تعبير ثابت الاتزان للمركبات القليلة الذوبان. |
| الأيون المشترك | أيون يدخل في تركيب اثنين أو أكثر من المركبات الأيونية. |
| تاثير الايون المشترك | انخفاض ذائبية المادة بسبب وجود أيون مشترك. |
الفصل الرابع ( الاتزان الكيميائي )
مفاهيم و معلومات الفصل الرابع
| مفاهيم | معلومات |
| التفاعل العكسي | ھو التفاعل الكیمیائي الذي یحدث في الاتجاھین الأمامي والعكسي . |
| الاتزان الكيميائي | ھو الحالة التي تتساوى عندھا سرعتي التفاعل الأمامي والعكسي ، وتثبت عندھا تراكیز المواد المتفاعلة والناتجة . سرعة التفاعل الأمامي = سرعة التفاعل العكسي |
| قانون الاتزان الكیمیائي | عند درجة حرارة معینة یمكن للتفاعل الكیمیائي أن یصل إلى حالة  |
| ثابت الاتزان الكیمیائي Keq | قیمة كسر بسطه حاصل ضرب تراكیز المواد الناتجة ومقامه حاصل ضرب تراكیز المواد المتفاعلة . |
| 1 < Keq | یعني أن تراكیز المواد الناتجة أكبر من تراكیز المتفاعلة عند الاتزان. |
| 1 > Keq | یعني أن تراكیز المواد المتفاعلة أكبر من تراكیز الناتجة عند الاتزان. |
| اتزان متجانس | یعني أن المتفاعلات والنواتج توجد في نفس الحالة الفیزیائیة |
| اتزان غیر متجانس | یعني أن المتفاعلات والنواتج توجد في أكثر من حالة فیزیائیة . |
| المواد الصلبة ( s ) والمواد السائلة ( l ) | لا تكتب في قانون ثابت الاتزان لأن لھا قیم ثابتة . |
| المواد الغازیة ( g ) و المحالیل ( aq ) | ھي التي تكتب في قانون ثابت الاتزان |
| قیمة Keq | له قیمة ثابتة عند درجة حرارة معینة |
| خواص الاتزان | 1- یجب أن یتم التفاعل في نظام مغلق . 2 -یجب أن تبقى درجة الحرارة ثابتة . 3 -الاتزان ذو طبیعة دینامیكیة نشطة ولیس ساكنا |
| العوامل المؤثرة في الاتزان الكیمیائي | 1 -تركیز المتفاعلات والنواتج 2 - الضغط 3 - درجة الحرارة 4 -العامل المحفز |
| مبدأ لوشاتلییه | إذا بذل جھد على تفاعل في حالة اتزان فإن التفاعل یسر في الاتجاه الذي یقاوم فعل ذلك المؤثر . ( الاتزان يتجه دائماً باتاه تعويض النقص ) |
| تعبیر ثابت حاصل الذائبیة | ھو تعبیر ثابت الاتزان للمركبات القلیلة الذوبان . |
| ثابت حاصل الذائبیة | ھو ناتج ضرب تراكیز الأیونات الذائبة كل منھا مرفوع لأس یساوي معاملھا في المعادلة الكیمیائیة |
| الأیون المشترك | ھو أیون یدخل في تركیب اثنین من أو أكثر من المركبات الأیونیة |
| تأثیر الأیون المشترك | انخفاض ذائبیة المادة بسبب وجود أیون مشترك |
الفصل الرابع ( الاتزان الكيميائي )
العوامل المؤثرة على الاتزان الكيميائي

1- تأثير التركيز : زيادة أو نقص التركيز لمادة متفاعلة أو ناتجة .
| العامل المؤثر | ينزاح الاتزان باتجاه | تركيز النواتج | تركيز المتفاعلات | قيمة ثابت الاتزان |
| إضافة تركيز مادة متفاعلة أو نقص تركيز مادة ناتجة | التفاعل الأمامي | يزيد | يقل | لا تتأثر |
| نقص تركيز مادة متفاعلة أو إضافة تركيز مادة ناتجة | التفاعل العكسي | يقل | يزيد | لا تتأثر |
2- تأثير الضغط : الضغط يتناسب عكسيا مع الحجم وطرديا مع التركيز يتأثر بالضغط عدد المولات الأكثر متفاعلات أو نواتج بالزيادة زيادة وبالنقص نقص
| العامل المؤثر | ينزاح الاتزان | تركيز النواتج | تركيز المتفاعلات | قيمة ثابت الاتزان |
| زيادة الضغط | ||||
| عدد مولات المتفاعلات اكثر | التفاعل الامامي | يزيد | يقل | لا تتأثر |
| عدد مولات النواتج اكثر | التفاعل العكسي | يقل | يزيد | لا تتأثر |
| نقص الضغط | ||||
| عدد مولات المتفاعلات اكثر | التفاعل العكسي | يقل | يزيد | لا تتأثر |
| عدد مولات النواتج اكثر | التفاعل الامامي | يزيد | يقل | لا تتأثر |
| عندما يتساوى عدد المولات في المتفاعلات والنواتج ليؤثر الضغط على التفاعل في حالة الاتزان . |
3- تأثير درجة الحرارة : حسب نوع التفاعل طارد أم ماص للحرارة.
| العامل المؤثر | ينزاح الاتزان باتجاه | تركيز النواتج | تركيز المتفاعلات | قيمة ثابت الاتزان |
| زيادة درجة الحرارة في تفاعل ماص للحرارة أو نقص درجة الحرارة في تفاعل طارد للحرارة | التفاعل الأمامي | يزيد | يقل | تزيد |
| نقص درجة الحرارة في تفاعل ماص للحرارة أو زيادة درجة الحرارة في تفاعل طارد للحرارة | التفاعل العكسي | يقل | يزيد | تقل |
الفصل الرابع ( الاتزان الكيميائي )
الحاصل الأیوني Qsp وتوقع الرواسب
الحاصل الأیوني Qsp:
ھو قیمة ثابت حاصل الذائبیة یتم فیھا قیاس تراكیز المواد في لحظة ما من لحظات التفاعل المتزن .
ثم یتم مقارنتھا بثابت حاصل الذائبیة للتفاعل الأصلي Ksp ویتم بذلك توقع الرواسب .
ويحدث أي مما يلي :
1- KSP > Qsp فإن المحلول غیر مشبع ، ولا یتكون راسب وللوصول إلى الاتزان یزید تركیز الأیونات لتزید قیمة Qsp حتى تتساوى مع Ksp( لیصبح المحلول مشبعا ) 2- Ksp = Qsp فإن المحلول مشبع ، ولا یحدث تغیر . أي أن التفاعل في حالة اتزان عندھا 3- Qsp > Ksp يتكون راسب وللوصول إلى الاتزان یقل تركیز الأیونات لتقل قیمة Qsp حتى تتساوى مع Ksp ( لیصبح المحلول مشبعا )
|
الفصل الخامس (مشتقات الركبات الهيدروكربونية وتفاعلاتها )
مفردات الفصل الخامس
| المفردات | دلالتها |
| الفكرة الرئيسة | يمكن أن تحل ذرة الهالوجين محل ذرة الهيدروجين في بعض المركبات الهيدروكربونية |
| المجموعة الوظيفية | هي ذرة أو ومجموعة من الذرات تكسب الركب العضوي خواص مميزة، وتتفاعل دائما بالطريقة نفسها ، فعند إضافتها إلى المركبات الهيدروكربونية ينتج دائما فيزيائية وكيميائية مختلفة عن الركبات الهيدروكربونية الأصلية. |
| هاليدات الألكيل | هي مركبات عضوية تحتوي على ذرة هالوجين أو أكثر مرتبطة برابطة تساهمية مع ذرة كربون أليفاتية. |
| هاليدات الأريل | هي مركبات عضوية تتكون من هالوجين مرتبط مع حلقة البنزين أو مجموعة أروماتية أخرى. |
| البلاستيك | بوليمر يمكن تسخينه وتشكيله عندما يكون لينا وهناك بلاستيك آخر يسمى الفينيل وهو البولير فينيل كلوريد(PVC ) و الذي يمكن صناعته في صورة لينة أو صلبة، ويمكن تشكيله على شكل صفائح رقيقة، و نماذج الألعاب. |
| تفاعلات الاستبدال | تحل فيها ذرة أو مجموعة ذرية محل مجموعة ذرية أخرى في المركب. |
| الهلجنة | تفاعل تحل فيه ذرة هالوجين ( مثل الكلور أو البروم ) محل ذرة هيدروجين |
| الفكرة الرئيسة | الأكسجين والنيتروجين من أكثر الذرات شيوعا في المجموعات الوظيفية العضوية |
| مجموعة اليدروكسيل | مجموعة الأكسجين والهيدروجين التي ترتبط برابطة تساهميه مع ذرة كربون. |
| الكحولات | المركبات العضوية الناتجة عن إحلال مجموعة هيدروكسيل محل ذرة هيدروجين |
| الإيثرات | مركبات عضوية تحتوي على ذرة اكسجين مرتبطة مع ذرتين كربون |
| الأمينات | ذرات نيتروجين مرتبطة مع ذرات الكربون في سلاسل الياتية أو حلقات اروماتية |
| الفكرة الرئيسة | تحتوي مركبات الكربونيل على ذرة أكسجين ترتبط برابطة ثنائية مع ذرة الكربون في المجموعة الوظيفية |
| مجموعة الكربو نيل | الترتيب الذي ترتبط فيه ذرة الاكسجين برابطة ثنائية مع ذرة كربون مجموعة الكربونيل |
| الألدهيدات | مركبات عضوية تقع فيها مجموعة الكربونيل في آخر السلسلة ، وتكون مرتبطة مع ذرة كربون متصلة بذرة هيدروجي من الطرف الآخر. |
الفصل الخامس (مشتقات الركبات الهيدروكربونية وتفاعلاتها )
تابع مفردات الفصل الخامس
| المفردات | دلالتها |
| الكيتونات | مركبات عضوية ترتبط فيها ذرة الكربون في مجموعة الكربونيل مع ذرتي كربون في السلسلة. |
| الاحماض الكربوكسيلية | مركبات عضوية تحتوي على مجموعة الكربوكسيل |
| مجموعة الكربوكسيل | تتكون من مجموعة كربونيل مرتبطة مع مجموعة هيدروكسيل |
| الإسترات | مركبات عضوية تحتوي على مجموعة كربوكسيل حلت فيها مجموعة ألكيل محل ذرة الهيدروجين الوجودة في مجموعة الهيدروكسيل. |
| الأميدات | مركبات عضوية تنتج عن إحلال ذرة نيتروجين مرتبطة مع ذرات أخرى محل مجموعة الميدات هيدروكسيل OH -في الحمض الكربوكسيلي. |
| الفكرة الرئيسة | تصنيف تفاعلات المركبات العضوية يجعل توقع نواتج التفاعلات أسهل |
| تفاعل التكثف | يتم فيه ارتباط اثنين من جزيئات صغيرة لركبات عضوية لتكوين جزيء آخر أكثر تعقيدا. |
| تفاعلات الحذف | عملية تكوين الألكين من الألكان أي تحويل الألكان إلى ألكين |
| تفاعلات حذف الهيدروجين | التفاعلات التي يصاحبها حذف ذرتي هيدروجين من الايثان. |
| تفاعلات حذف الماء | تفاعلات الحذف التي يصاحبها تكوين الماء. |
| تفاعلات إضافة | تحدث عندما ترتبط ذرات أخرى مع ذرات الكربون المكونة للرابطة التساهمية الثنائية أو تفاعلات الثالثية. |
| تفاعلات إضافة الماء | حيث يتم فيها إضافة ذرة الهيدروجين ومجموعة الهيدروكسيل من جزيء الماء إلى الرابطة الثنائية أو الثالثية. |
| تفاعلات الهدرجة | تفاعلات إضافة الهيدروجين إلى ذرات الكربون التي تكون الرابطة الثنائية أو الثالثية. |
| الفكرة الرئيسة | البوليمرات الصناعية مركبات عضوية كبيرة تتكون من تكرار وحدات مرتبطة معا عن طريق تفاعلات الضافة أو التكثف . |
| البوليمرات | جزيئات كبيرة تتكون من العديد من الوحدات البنائية المتكررة. |
| المونومرات | هي الجزيئات التي يصنع منها البوليمر. |
| تفاعلات البلمرة | هي التفاعلات التي ترتبط فيها المونومرات. |
| البلمرة بالإضافة | تبقى جميع الذرات الوجودة في الونومر في تركيب البوليمر. |
| البلمرة بالتكثف | عندما تحتوي المونومرات على اثنتين من المجموعات الوظيفية على الأقل تتحد معا و يصاحب ذلك خسارة جزيء صغير غالبا ما يكون الماء |
تسمية المركبات العضوية
| المجموعة الوظيفية | التسمية النظامية | التسمية الشائعة |
| الھالیدات R-X , Ar-X | ھالو ألكان مثال/ كلوروبروبان | ھالید ألكیل مثال / كلورید بروبیل |
| الكحولات R-OH | ألكانول مثال/ بروبانول | كحول ألكیلي مثال / كحول بروبیلي |
الإيثرات R-O-R’ | غير مطلوبة | إیثر ألكیلي مثال/ إیثیل میثیل إیثر |
| الأمینات R-NH2 | أمینو ألكان | أمین ألكیلي مثال/ أمین بروبیلي |
| الألدھیدات R-CHO | ألكانال مثال / بروبانال | ألكان ألدھید مثال/ بروبان ألدھید |
| الكیتونات ’R-CO-R | ألكانون مثال/ بروبانون | ألكان كیتون مثال / بروبان كیتون |
| الأحماض الكربوكسیلیة R-COOH | حمض ألكانویك مثال/ حمض بروبانویك | حسب مصدر الحمض مثال / حمض الفورمیك ، حمض الأسیتیك |
| الأمیدات R-CO-NH2 | ألكان أمید بروبان أمید | حسب مصدر الأمید مثال / كاربامید (الیوریا) |
| الإسترات ’R-COO-R | ألكانوات الألكیل أو ألكانات الأكیل مثال/ بروبانوات المیثیل | حسب مصدر الحمض في الاستر مثال / خلات المیثیل أو اسیتات المیثیل |
الفصل الخامس (مشتقات الركبات الهيدروكربونية وتفاعلاتها )
أهم استخدامات الفصل الخامس
| المواد العضوية و العمليات | التطبيقات و الاستخدامات |
| هاليدات الآلكيل X-R | السليكون تجاريا هو كلوروميثان . تستعمل هاليدات الألكيل كمواد أولية في الصناعات الكيميائية كمذيبات وأدوات تنظيف . ( PTFE ) مبلمر رباعي فلورو بولي إيثين يستخدم لصناعة البلاستيك اللي . ( PVC ) مبلمر كلوريد البولي فينيل يصنع منه بلاستيك لين أو صلب ، ويمكن تشكيله على شكل صفائح رقيقة ونماذج للألعاب . |
| R-OH الكحولت | الإيثانول ينتج من تخمر السكريات ويستخدم في الطب كمطهر ، وكمعقم للجلد قبل إعطاء الحقن . ويضاف للبنزين وكمذيب جيد وله استخدامات صناعية أخرى . الميثانول مذيب في الصناعة كالدهانات . 2- بيوتانول مذيب لبعض الصباغ . الجليسرول يستعمل كمانع لتجمد وقود الطائرات |
| الإيثرات R-O-R. | استعمل ثنائي إيثيل إيثر كمادة مخدرة في العمليات الجراحية |
| R-NH2 الأمينات | يستعمل الأنيلين في إنتاج الصباغ ذات الظلال العميقة اللون . يستعمل هكسيل حلقي أمي والإيثيل أمين في صناعة البيدات الحشرية والمواد البلاستيكية والأدوية والمطاط المستعمل في صناعة الإطارات . للأمينات رائحة غير مقبولة من الإنسان وهي المسؤولة عن الروائح الميزة للمخلوقات الميتة والمتحللة ، وتستعمل رائحتها في التحقيق الجنائي |
| الألدهيدات RCHO | محلول الفورمالدهيد يستعمل في حفظ العينات الحية . ويستعمل الورمالدهيد للتفاعل مع اليوريا لصنع نوع من الشمع المقاوم ، واملواد البلاستيكية الصلبة الستعملة في صنع الزرار ، وقطع غيار السيارات ، والأجهزة الكهربائية وغراء الخشب . البنزالدهيد والساليسالدهيد لهما رائحة اللوز الطبيعية . السينامالدهيد له رائحة القرفة ومذاقها |
| الكيتونات R-CO-R | يعد الكيتون مذيبا شائها للشمع و البلاستيك و الطلاء و الورنيش و الغراء |
الفصل الخامس (مشتقات الركبات الهيدروكربونية وتفاعلاتها )
تابع أهم تطبيقات الفصل الخامس
| المواد العضوية والعمليات | الاستخدامات والتطبيقات |
| الأحماض الكربوكسیلیة R-COOH | حمض المیثانویك (حمض الفورمیك أو حمض النمل) تفرزه النملة للدفاع عن نفسھا . حمض الإیثانویك (حمض الأستیك أو حمض الخل) ، حمض اللاكتیك في اللبن وغیرھا |
| R-COO-R ’الإسترات | تستعمل الإسترات في كثیر من الأطعمة والنكھات والمشروبات والعطور والشموع العطریة والمواد المعطرة الأخرى |
R-CO-NHR الأمیدات‘ | توجد مجموعة الأمید في البروتینات . الیوریا من الأمیدات وھي ناتج ھضم البروتینات ویصنع منھا الأسمدة الزراعیة وتستعمل كغذاء للماشیة والأغنام |
| تفاعلات الھدرجة | تحول السوائل الدھنیة الغیر مشبعة الموجودة في الزیوت النباتیة إلى دھون مشبعة صلبة والتي تستعمل فیھا الدھون المھدرجة ( صنع السمن). |
| البولیمرات | جزیئات كبیرة تتكون من وحدات بنائیة متكررة . الباكالایت أول بولیمر صناعي وھو نوع من البلاستیك مقاوم للحرارة. |
| المونومرات | الجزیئات التي یصنع منھا البولیمر |
| البلمرة بالإضافة | تبقى جمیع الذرات التي في المونومر موجودة في البولیمر . تنتج معظم المبلمرات بھذه الطریقة. |
| البلمرة بالتكثف | تتحد اثنتین من المجموعات الوظیفة في المونومرات لینتج عنھا جزيء ماء . وبھذه الطریقة یحضر النایلون |
| بولي كلورید الفینیل (PVC ) | أنابیب بلاستیكیة ، تغطیة اللحوم والمفروشات ، وملابس المطر ، جدران المنازل وخراطیم المیاه . یمكن صناعته بصورة لینة أو صلبة وتشكیله على شك صفائح رقیقة أو نماذج للألعاب . |
| بولي بروبلین (PP ) | صنع أوعیة المشروبات ، والحبال ، وأدوات المطبخ. |
| بولي ستایرین (PS ) | صنع رغوة التغلیف والعزل ، وأوعیة للنباتات ، وحاویة لحفظ الطعام ، وعمل النماذج . |
| بولي إیثلین رباعي فثالات ( PETE ) | صنع زجاجات العصیر والحلیب ، والإطارات ، والملابس ، وأواني الطعام التي تستعمل مرة واحدة |
| أھمیة تدویر البولیمرات | لتقلل من استعمال الوقود الأحفوري |
الفصل الخامس (مشتقات الركبات الهيدروكربونية وتفاعلاتها )
تفاعلات الفصل الخامس
| المواد العضوية والتفاعلات | التفاعلات الكيميائية |
| تفاعلات الاستبدال | |
| تفاعلات الاستبدال ( الھلجنة ) | ھالید ألكیل → ھالوجین + ألكان |
| تفاعلات الاستبدال ( تكوین الكحولات ) | -X + كحول → -OH + ھالید ألكیل |
| تفاعلات الاستبدال ( تكوین الأمینات ) | HX + أمین → NH3 + ھالید ألكیل |
تفاعلات التكاثف
| تفاعلات التكاثف | H2O + إستر → حمض كربوكسیلي + كحول |
الحذف
| تفاعلات حذف الھیدروجین | H2 + ألكین → ألكان |
| تفاعلات حذف ھالیدالھیدروجین | HX + ألكین → ھالید الألكیل |
| تفاعلات حذف الماء | H2O + ألكین → كحول |
تفاعلات الإضافة
| تفاعلات إضافة الماء | كحول → H2O + ألكین |
| تفاعلات إضافة الھیدروجین ( الھدرجة ) | ألكان → H2 + ألكین ألكین → H2 + ألكاین (1مول ) ھیدروجین ألكان → H2 + ألكین →H2 + ألكاین (2مول) ھیدروجین |
| تفاعلات إضافة ھالیدالھیدروجین | ھالید الألكیل → HX + ألكین |
| تفاعلات إضافة الھالوجین ( الھلجنة ) | ثنائي ھالید ألكیل → X2 + ألكین |
تفاعلات الاكسدة و الاختزال
| تحويل الألكانات إلى كحولات |  |
| تحويل الكحولات إلى الألدهيدات ثم إلى أحماض كربوكسيلية |  |
| تحويل الكحولات إلى كيتونات |  |