تلخيص كيمياء 4 ثانوي مقررات أ. هادي المالكي
الفصل الاول : الغازات
قوانين الغازات
قانون بويل : ينص على ان حجم كمية محددة من الغاز يتناسب عكساً مع الضغط الواقع عليه عند ثبوت درجة حرارته .
P1 V1 = P2 V2
(راجع حلول المسائل في الملزمة )
الصفر المطلق : هو اقل قيمة ممكنة لدرجة الحرارة التي تكون عندها طاقة الذرات اقل ما يمكن و هو الصفر على تدريج كلفن .
قانون شارل : ينص على ان حجم كمية محددة من الغاز يتناسب طردياً مع حرارته بالكلفن عند ثبوت الضغط .
V1 /T1 = V2 /T2
( راجع حلول المسائل في الملزمة )
قانون جاي لوساك : ينص على ان ضغط مقدار محدد من الغاز يتناسب طردياً مع درجة الحرارة بالكلفن له عند ثبوت الحجم .
P1 V1 /T1 = P2 V2 /T2
( راجع حلول المسائل في الملزمة )
قانون الغاز المثالي :
مبدأ افوجادرو : ينص علة الحجوم المتساوية من الغاز المختلفة تحتوي العدد نفسه من الجسيمات عند نفس درجة الحرارة و الضغط .
الحجم المولاري : لغاز هو الحجم الذي يشغله 1mol منه عند الظروف المعيارية ( 0c ) ( 1atm )
بين افوجادرو ان 1mol من اي غاز يشغل حجماً مقداره 22.4L / mol بوصفه معامل تحويل عندما يكون الغاز في الظروف المعيارية .
( ويستخدم هذا المعامل في حل المسائل عند الظروف المعيارية ) . و هذا المعمل هو n = v /22.4
حيث n هي عدد المولات v هو الحجم .
( راجع حلول المسائل في الملزمة )
ثابت الغاز اامثالي : يرمز له بالرمز R و قيمة R هي 0.0821 L.atm/mol.K
قانون الغاز المثالي : يصف السلوك الفيزيائي للغاز المثالي من حيث الضغط و الحجم و درجة الحرارة و عدد مولات الغاز المتوافرة .
PV = nRT
( راجع حلول المسائل في الملزمة )
الكتلة المولية و قانون الغاز المثالي M = m/M
( m الكتلة بالجرام , M الكتلة المولية )
M = mRT / PV
الكثافة و قانون الغاز المثالي D = m/ V
( D الكثافة , V الحجم , m الكتلة بالجرام )
D = MP/ RT
الغاز الحقيقي و الغاز المثالي :
متى يكون الغاز المثالي غير مناسب للاستخدام مع الغاز الحقيقي ؟
تحيد معظم الغازات الحقيقية في سلوكها عن الغاز المثالي عند الضغط العالي و درجات الحرارة المنخفضة .
( تسلك الغازات الحقيقية عند الضغط العالي و درجات الحرارة منخفضة سلوكا مغايرا لسلوك الغاز المثالي )
القطبية و حجم الجسيمات :
لا تسلك الغازات القطبية سلوك الغاز المثالي .
تميل جسيمات الغاز الكبيرة الى الابتعاد عن سلوك المثالي اكثر من جسيمات الغاز الصغيرة .
الحسابات المتعلقة بالغازات
الحسابات الكيميائية حساب الحجم
لايجاد غاز متفاعل او ناتج عن في التفاعل الكيميائي يجب عليك معرفة المعادلة الكيميائية الموزونة لهذا التفاعل و حجم غلز اخر مشارك في التفاعل على الاقل .
المعاملات في المعادلة الموزونة تمثل النسب الحجمية للغازات المشاركة في التفاعل .
( راجع حلول المسائل في الملزمة )
حسابات الحجم - الكتلة
المعادلة الكيميائية الموزونة تبين اعداد المولات و الحجوم النسبية للغازات فقط و ليس كتلها لذا يجب ان يتم تحويل كل الكتل المعطاة الى مولات او حجوم قبل استخدامها جزءا من النسبة تذكر ايضا ان وحدة درجة الحرارة يجب ان تكون بالكلفن .
( راجع حلول المسائل في الملزمة )
الصيغة العامة لتفاعل البلمرة حيث تمثل n عدد الوحدات المتكررة
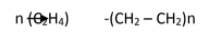
الفصل الثاني : المخاليط و المحاليل
انواع المخاليط
المخاليط غير المتجانسة
المخلوق المعلق : مخلوط يحتوي على جسيمات يمكن ان تترسب بالترويق .
مثل / مخلوط الرمل و الماء ( ماء الوحل )
المخلوط الغروي : هو المخلوط الذي يتكون من جسيمات متوسطة الحجم و تتراوح اقطارها بين 1000nm-1nm ولا تترسب .
مثال / يعد الحليب مخلوط غروي
تسمى المادة الاكثر توافر في المخلوط وسط الانتشار .
_ امثلة على انواع المخاليط الغروية :
- صلب في صلب : الاحجار الكريمة الملونة
- صلب في سائل : الدم الجيلانين
- الهباء الجوي الصلب : الدخان الغبار في الهواء
- الهباء الجوي السائل : الغيوم و الضباب
- مستحلب : الحليب
- الحركة البروانية : تتحرك الجسيمات المنتشرة في المخاليط الغروية السائلة حركة عشوائية عنيفة
- تأثير تندال : هي ظاهرة في المخاليط الغروية تعمل على تشتت الضوء
( تظهر المخاليط الغروية و المعلقة تأثير تندال )
_ هناك نوعان من المخاليط غير المتجانسة هما المخلوط المعلق و المخلوق الغروي .
المخاليط المتجانسة
المحاليل مخاليط متجانسة تحتوي على مادتين او اكثر
لا يمكن التمييز بين المذيب و المذاب عند النظر الى المحلو
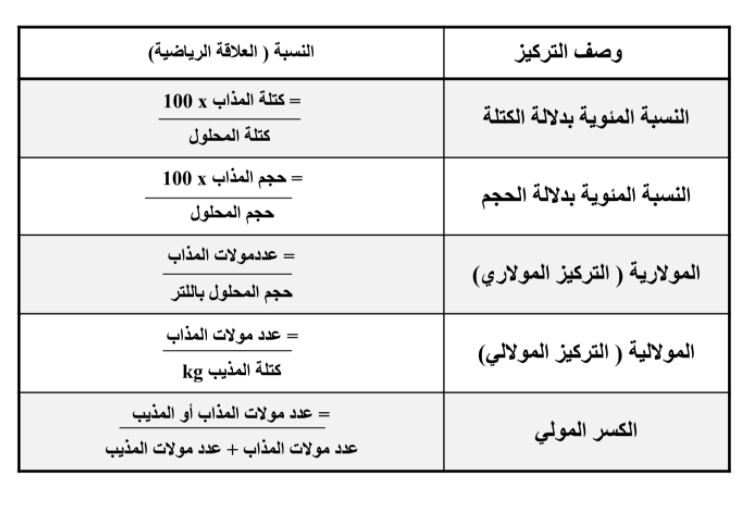
تركيز المحلول :
التركيز : هو مقياس يعبر عن كمية المذاب الذائبة في كمية محددة من المذيب او المحلول
المولارية M / هي عدد مولات المذاب الذائبة في لتر من المحلول تعرف ايضاً بالتركيز المثالي
_ معادلة التخفيف
M1 V1 = M2 V2
المولارية m : يرمز اليه بالرمز m و يكون تركيز المحلول الذي يحتوي على 1mol من الماب في 1kg .
الكسر المولي : هو نسبة عدد مولات المذاب او المذيب في المحلول الى عدد المولات الكلية للمذيب و المذاب و يستعمل الرمز X .
( راجع القوانين و حلول المسائل في الملزمة )
العوامل المؤثرة في الذوبان :
الذوبان : هي عملية إحاطة جسيمات المذاب بجسيمات المذيب و المذيب يذيب شبيهه .
_ محاليل المركبات الايونية : مثل كلوريد الصوديوم NaCl و لا يمكنك اذابة جميع المركبات الايونية في الماء فالجبس لا يذوب في الماء لان قوى التجاذب بين ايونات الجبس قوية .
_ محاليل المركبات الجزيئية : مثل سكر المائدة يكون روابط هيدوجينية مع الماء و يذوب فيه , اما الزيت فلا يذيب الا في مذيب غير قطبي .
_ حرارة الذوبان : هو التغير الكلي للطاقة الذي يحدث خلال عملية تكون المحلول .
_ العوامل المؤثرة في الذوبان :
- التحريك
- مساحة السطح : ملعقة من السكر المطحون تذوب اسرع من الكمية نفسها التي تكون في صورة مكعبات .
- الحرارة : تتأثر سرعة الذوبان بدرجة الحرارة و المذيب الساخن يذيب كمية اكبر من المذاب مقارنة بالمذيب البارد , ذوبان بعض المواد و منها الغازات يقل بزيادة درجة الحرارة , و هذا يجعل المشروبات الغازية تفقد طعمها اللاذع اسرع عند درجة حرارة الغرفة مما لو كانت باردة .
- الذائبية : هي اقصى كمية من المذاب يمكن ان تذوب في كمية محددة من المذيب عند درجة حرارة معينة .
- المحلول غير المشبع : يحتوي على كمية مذاب اقل مما في المحلول المشبع عند درجة حرارة و ضغط معينين .
- المحلول المشبع : يحتوي على اكبر كمية من المذاب ذائبة في كمية محددة من المذيب عند درجة حرارة و ضغط معينين .
- المحلول فوق المشبع : يحتوي على كمية اكبر من المادة المذابة مقارنة بمحلول مشبع عند درجة الحرارة نفسها .
- ذائبية الغازات : تقل ذائبية غازي الاكسجين و ثاني اكسيد الكربون عند درجات الحرارة المرتفعة مقارنة بدرجات الحرارة المنخفضة .
- الضغط و قانون هنري : كلما ازداد الضغط فوق المحلول زادت ذائبية الغاز في اي مذيب تعتمد المشروبات الغازية على هذا المبدأ .
- قانون هنري : ينص على ان تتناسب ذائبية الغاز في سائل تناسباً طرديا مع ضغط الغاز الموجود فوق السائل عند ثبوت درجة الحرارة S1 P1 = S2 P2
من الممكن ان يكون المحلول غير مشبع او مشبع او فوق مشبع .
الخواص الجامعة للمحاليل :
تعتمد الخواص الجامعة على عدد جسيمات المذاب في المحلول .
_ تشمل الخواص الجتمعة :
الانخفاض في الضغط البخاري , و الارتفاع في درجة الغليان , و الانخفاض في درجة التجمد , و الضغط الاسموزي .
*المواد المتأينة في محلول مائي: المركبات الايونية مواد توصل الكهرباء لذلك تسمى مواد إلكتروليتية .
*المواد غير المتأينة في المحلول المائي : تذوب الكثير من المركبات الجزيئية في المذيبات و لكنها لا تتأين تسمى المواد المذابة غير متأينة مثل السكروز .
*الانخفاض في الضغط البخاري : يعتمد على جسيمات المذاب في المحلول و لذلك فهو من الخواص الجامعة للمحاليل .
تأثير 1mol من كل المواد المذابة المتأينة NaCl و Na2SO4 و AlCl3 يزداد في الضغط البخاري بسبب تزايد اعداد الايونات التي ينتجها كل منها في محلولها .

*الارتفاع في درجة الغليان : هو الفرق بين درجة حرارة غليان المحلول و درجة غليان المذيب النقي .
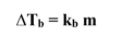
الارتفاع في درجة غليان المحلول = درجة غليان المحلول - درجة غليان المذيب النقي .
*الانخفاض في درجة التجميد المحلول : هو الفرق بين درجة تجمد المحلول و درجة تجمد المذيب النقي لموجود في المحلول .
الانخفاض في درجة تجمد المحلول = درجة تجمد المذيب النقي - درجة تجمد المحلول
درجة تجمد المحلول دائماً اقل من درجة تجمد المذيب النقي .
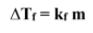
عند معرفة التركيز المولالي لمحلول ما يمكنك حساب و اعتماداً على عدد الجسيمات في المحلول .
حدد الارتفاع في درجة الغليان و الانخفاض في درجة التجمد ثن اضف الى درجة الغليان و اطرح من درجة التجمد .
*الخاصية الاسموزية : هي انتشار المذيب خلال غشاء شبه منفذ من المحلول الاقل تركيزاً الى المحلول الاكثر تركيزاً .
تلعب الخاصية الاسموزية دوراً مهماً في الكثير من العمليات الحيوية و منها امتصاص الغذاء في النبات .
*الضغط الاسموزي : كمية الضغط الناتج عن انتقال جزيئات الماء الى المحلول المركز .
يعتمد الضغط الاسموزي على عدد جسيمات المذاب في كمية محددة من المحلول و هو خاصية جامعة للمحاليل .
الفصل الثالث : الاحماض و القواعد
مقدمة في الاحماض و القواعد :
المحاليل الحمضية طعمها لاذعالمحاليل القاعدية طعمها مر و لها ملمس زلق .
للمحاليل الحمضية و القاعدية القدرة على توصيل الكهرباء .
_ التفاعل مع ورق تباع الشمس : تحول المحاليل الحمضية لون ورق تباع الشمس الى الاحمر و تحول المحاليل القاعدية لونه الى الازرق .
_ تفاعل الاحماض مع الفلزات : حينما يتفاعل المغانيسيوم و الخارصين مع محاليل الاحماض ينتج عن هذا التفاعل غاز الهيدروجين .
_ تفاعل الاحماض مع الكربونات او البيكربونات :
تتفاعل كربونات الفلزات و كربونات الفلزات الهيدروجينية مع محاليل الاحماض منتجة غاز ثاني اكسيد الكربون CO2 , وينتج غاز CO2 الذي يسبب ظهور الفقاعات .
_ ايونات الهيدرنيوم و الهيدروكسيد :
تحتوي المحاليل المائية جميعها على ايونات الهيدرونيوم و ايونات الهيدروكسيد .
وتحدد الكميات النسبية من الايونين ما اذا كان المحلول حمضياً او قاعدياً او متعادلاً .
*المحلول الحمضي : يحتوي على ايونات هيدروجين اكثر من ايونات الهيدروكسيد .
*المحلول القاعدي : يحتوي على ايونات هيدروكسيد اكثر من ايونات الهيدروجين .
*المحلول المتعادل : فيحتوي على تركيزين متساويين من ااايونات الهيدروجين و ايونات الهيدروكسيد .
*عملية التأين الذاتي :
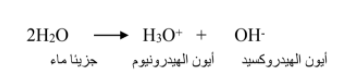
أيون الهيدرونيوم عبارة عن ايون هيدروجين مرتبط مع جزيء ماء برابطة تساهمية . و يمكن استعمال الرمزين و بالتبادل , اي وضع احدهما مكان الاخر , كما تبين المعادلة المبسطة للتأين الذاتي :
_ تظرية أرهينيوس للاحماض و القواعد :
الحمض : مادة تحتوي على الهيدروجين , و تتأين في المحاليل المائية منتجة ايونات الهيدروجين .
القاعدة : مادة تحتوي على مجموعة الهيدروكسيد . و تتفكك في المحلول المائي منتجة ايون الهيدروكسيد .
*احماض و قواعد ارهينيوس يوجد معادلات انظر صفحة رقم 93 .
و على الرغم من ان نموذج ارهينيوس يفسر الكثير من المحاليل الحمضية و القاعدية , الا انه لا يخلو من بعض السلبيات , فمثلاً لا تحتوي الامونيا NH3 و كربونات الصوديوم Na2CO3 على مجموعة الهيدروكسيد الا انهما ينتجان في الماء ايون الهيدروكسيد .
_ تظرية برونستد - لوري للاحماض و القواعد :
الحمض هو المادة المانحة لايون الهيدروجين , في حين تكون القاعدة هي المادة المستقبلة لهذا الايون .
تامواد المانحة لايون الهيدروجين و المواد المستقبلة له يوجد معادلة انظر صفحة رقم 92 .
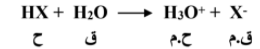
الحمض المرافق ( المقترن ) هو المركب الكيميائي الذي ينتج عندما نستقبل القاعدة أيون الهيدروجين .
القاعدة المرافقة ( المقترنة ) فهي المركب الكيميائي الذي ينتج عندما يمنح الحمض ايون الهيدروجين .
تتكون تفاعلات برونستد _ لوري من أزواج مترافقة من الحمض و القاعدة .
فلوريد الهيدروجين - حمض برونستد - لوري يوجد معادلتين انظر صفحة 95 .
HF في الماء , فلوريد الهيدروجين قاعدته المرافقة .
جزيء الامونيا NH3 يستقبل ايون فإن الامونيا تصنف قاعدة برونستد - لوري في التفاعل الامامي .
_ مواد مترددة ( أمفوتيرية ) مثل : الماء و المواد الاخرى التي تستطيع ان تسلك سلوك الاحماض و القواعد .
_ الاحماض الاحادية البروتون : الحمض الذي يستطيع ان يمنح ايون هيدروجين واحدا فقط يسمى حمض احادي البروتين و من حمض البيروكلوريك HClO4 , و حمض النيتريك HNO3 و حمض الهيدروبروميك HBr , و حمض الإيثانويك ( حمض الخل ) CH3CooH …
_ الاحماض المتعددة البروتونات : تمنح بعض الاحماض اكثر من ايون هيدروجين , حمض الكبريتيك H2SO4 و حمض الكربونيك H2CO3 حمض الفوسفوريك H3PO4 و حمض البوريك H3BO3 .
_ نظرية لويس للاحماض و القواعد :
حمض لويس : مادة مستقبلة لزوج من الالكترونات . قاعدة لويس : مادة مانحة لزوج من الالكترونات .
مانحات و مستقبلات ازواج الالكترونات يوجد معادلة صفحة 98 .
يمثل ايون في هذا التفاعل حمض لويس و يمثل ايون الفلوريد قاعدة ليس ..
_ ملخص النظريات الثلاث للاحماض و القواعد :

يعد تفاعل SO3 مع MgO مهماً :
لانه ينتج بلورات من ملح كبريتات الماغنسيوم , تعرف باسم ملح إبسوم .
و لهذا الملح استعمالات كثيرة , منها تخفف آلام العضلات , و هو مغذٍّ للنباتات .
اذا ترك SO3 لينتشر في الغلاف الجوي فسوف يتحد مع الماء الموجود في الهواء مكوناً حمض الكبريتيك الذي يسقط على الارض في صورة مطر حمضي .
الانهيدريدات ( هي جزيئات منزوع منها الماء ) . مثلاً تتحد جزيئات غلز ثاني اكسيد الكربون بجزيئات الماء في الجو لتكون حمض الكربونيك H2CO3 الذي يهطل مع المطر , ويتكون ماء المطر الحمضي .
قوة الاحماض و القواعد :
تتأين الاحماض و القواعد القوية في المحاليل تأيناً تاماً , بينما الاحماض و القواعد الضعيفة في المحاليل تأيناً جزئياً .
الاحماض القوية : هي الاحماض التي تتأين كلياً أمثلة / H2SO4 , HNO3 , HCl
الأحماض الضعیفة : ھي الأحماض التي تتأین جزئیا . أمثلة / H2CO3 , CH3COOH , HF
معادلات التأين جدول 3 - 3 انظر صفحة 101 .
Ka ثابت تأين الحمض , و هو قيمة ثابت الاتزان لتأين الحمض الضعيف و تكون قيم Ka للاحماض الاضعف اصغر .
( راجع حل المسائل الندريبية في الملزمة ) .
القواعد القوية : القاعدة التي تتحلل كلياً تعرف بأنها قاعدة قوية , منتجة ايونات فلزية و ايونات الهيدروكسيد .
القواعد الضعيفة : تتأين جزئياً فقط في المحاليل المائية المخففة .
معادلات التأين للقواعد القوية جدول 3 - 5 صفحة 104 .
ثابت التأين لبعض القواعد جدول 3 - 6 صفحة 105 .
ثابت تأين القاعدة Kb بأنه قيمة تعبر عن ثابت الاتزان لتأين القاعدة . و كلما صغرت قيمة Kb كانت القاعدة اضعف .
ايونات الهيدروجين و الرقم الهيدروجيني .
Kw ثابت تأين الماء :
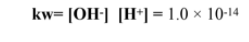
Kw و مبدأ لوتشاتلييه : حاصل ضرب و يساوي عند درجة حرارة 298 K
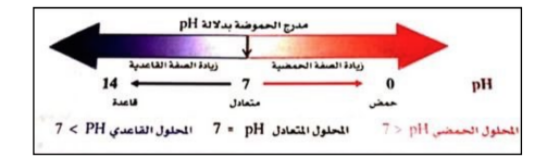
يعبر الكيميائيون عن تركيز عن تركيز ايونات الهيدروجين باستعمال تدريج الرقم الهيدروجيني pH
الرقم الهيدروجيني pH
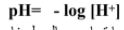
قيمة pH لمحلول ما تساوي سالب لوغاريتم تركيز ايون الهيدروجين , قيم pH للمحاليل الحمضية عند درجة حرارة 298 K اقل من 7 .
الرقم الهيدروكسيدي pOH
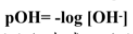
قيمة pOH لمحلول ما تساوي سالب لوغاريتم تركيز ايون الهيدروكسيد .
_ العلاقة بين pOH و pH
pH + pOH = 14
_ حساب تركيز الايونات من قيم pOH او pH

الشكل يوضح العلاقة بين pH و تركيز , و العلاقة بين pOH و تركيز عند درجة حرارة 298 K .
التعادل :
و الملح مركب ايوني يتكون من ايون موجب من قاعدة و ايون سالب من حمض , لذا يكون تفاعل التعادل إحلالاً مزدوجاً .
كتابة معادلات التعادل يوجد معادلة انظر صفحة رقم 115 .
عندما يتفاعل حمض قوي HCl مع قاعدة قوية NaCl و يتكون NaCl ملح قابل للذوبان .
_ المعايرة : طريقة لتحديد تركيز محلول ما , و ذلك بتفاعل حجم معلوم منه محلول تركيزه معلوم .
نقطة التكافؤ : هي نقطة يتساوى عندها عدد مولات من الحمض مع عدد مولات من القاعدة .
نقطة التكافؤ : او هي النقطة التي يتساوى عندها عدد مولات الحمض مع عدد مولات القاعدة .
و تسمى نقطة التكافؤ بنقطة التعادل في حالة تفاعل الاحماض و القواعد القوية .
_ كواشف الاحماض و القواعد : هي الاصباغ الكيميائية التي تتأثر الوانها بالمحاليل الحمضية و القاعدية كواشف الاحماض و القواعد .
_ نقطة نهاية المعايرة : تسمى النقطة التي يتغير لون الكاشف عندها .
_ تميه الاملاح : تفاعل الكثير من الاملاح مع الماء في عملية تعرف باسم .
_ الاملاح التي تنتج محاليل قاعدية :
مثال ينتج ملح فلوريد البوتاسيوم عن قاعدة قوية KOH و حمض ضعيف HF .
_ الاملاح التي تنتج محاليل حمضية :
ينتج ملح نترات الصوديوم NaNO3 عن حمض قوي HNO3 و قاعدة قوية NaOH يكون حلول نترات الصوديوم متعادلاًص .
_ المحاليل المنظمة :
محاليل تقاوم التغيرات في قيم pH عند اضافة كميات محددة من الاحماض او القواعد .
المحلول المنظم يتكون من خليط حمض ضعيف مع قاعدته المرافقة, او قاعدة ضعيفة مع حمضها المرافق .
_ سعة المحلول المنظم : كمية الحمض او القاعدة التي يستطيع المحلول المنظم ان يستوعبها دون تغير مهم في pH .
الفصل الرابع : تفاعلات الاكسدة و الاختزال
الاكسدة و الاختزال :
التفاعلات الذي انتقلت فيه الالكترونات من إحدى الذرات الى ذرة اخرى تفاعل الاكسدة و الاختزال .
_ عملية الاكسدة : هي فقدان ذرات المادة للالكترونات . و تعني الزيادة في عدد الاكسدة .
_ عملية الاختزال : هي اكتساب ذرات المادة الالكترونات . و تعني النقص في عدد الاكسدة .
المادة التي يحدث لها اختزال ( تكتسب الكترونات ) تسمى عامل مؤكسد .
المادة التي يحدث لها اكسدة ( تفقد إلكترونات ) فتسمى عامل مختزل .
التطبيقات الشائعة على تفاعلات الاكسدة و الاختزال إزالة الشوائب من الفلزات إضافة مبيض الغسيل الى الملابس لتبييضها .
( راجع حل المسائل التدريبية في الملزمة )
قواعد تحديد اعداد التأكسد للعناصر جدول 4 - 2 صفحة 144 .
( راجع حل المسائل التدريبية في الملزمة )
وزن معادلات الاكسدة و الاختزال
طريقة عدد التأكسد جدول 4 - 4 صفحة 147
( راجع حل المسائل التدريبية في الملزمة ) راجع وزن المعادلات الكيميائية الكتاب ص 148 - 150 - 153
يصعب وزن معظم معادلات الاكسدة و الاختزال باستعمال الطريقة التقليدية .
_ وزن الاكسجين يضاف جزيئات ماء في جهة نقص الاكسجين بمقدار نقص الاكسجين و لا يعتمد على نوع الوسط .
_ وزن الهيدروجين يعتمد على نوع الوسط .
في الوسط الحمضي : يوزن الهيدروجين بإضافة في جهة نقص الهيدروجين بمقدار النقص .
في الوسط القاعدي : يوزن الهيدروجين بإضافة في جهة نقص الهيدروجين بمقدار النقص و في الجهة الاخرى يضاف ايونات .
نصف التفاعل هو احد جزئي تفاعل الاكسدة و الاختزال .
الفصل الخامس : الكيمياء الكهربائية
الخلايا الجلفانية :
تحدث الاكسدة في الخلایا الجلفانیة عند الأنود ( المصعد ) منتجة إلكترونات تتدفق نحو الكاثود ( المھبط ) حیث یحدث الاختزال .
الكیمیاء الكھربائیة: ھي دراسة عملیات الأكسدة والاختزال التي تتحول من خلالھا الطاقة الكیمیائیة إلى طاقة كھربائیة، وبالعكس.
_ القنطرة الملحیة: استمرار للتفاعل ، وھي ممر لتدفق الأیونات من جھة لأخرى .
_ الخلیة الكھروكیمیائیة: جھاز یستعمل تفاعل الأكسدة والاختزال لإنتاج طاقة كھربائیة، أو یستعمل الطاقة الكھربائیة لإحداث تفاعل كیمیائي.
_ الخلیة الجلفانیة نوع من الخلایا الكھروكیمیائیة التي تحول الطاقة الكیمیائیة إلى طاقة كھربائیةً بواسطة تفاعل الأكسدة والاختزال التلقائي .
الشكل 5 - 2 صفحة 169
تتكـون الخلایـا الكھروكیمیائیة من جزأین یطلق عـلى كل منھما نصف الخلیة
یحتوي كل نصف خلیة على قطب ومحلول یشتمل على أیونات.
القطب الذي یحدث عنده تفاعل الأكسدة الأنود anode ( المصعد )
یسمى القطب الذي یحدث عنده تفاعل الاختزال الكاثود cathod ( المھبط )
الفولت ھو الوحدة المسـتعملة في قیاس جھد الخلیة.
مدى قابلیة المادة لاكتساب الإلكترونات ھو جھد الاختزال
یقاس جھد الاختزال لكل الأقطاب مقابل قطب واحد، فاختاروا قطب الھیدروجین القیاسي
تكون من شریحة صغیرة من البلاتین مغموسة في محلول حمض الھیدروكلوریك HCl الذي یحتوي على أیونات ھیدروجین بتركیز 1M. ویتم ضخ غاز الھیدروجین H2 في المحلول عند ضغط 1 atm ودرجة حرارة 25 °C، وتعرف ھذه الظروف بالظروف القیاسیة ( STP ) فرق الجھد لقطب الھیدروجین القیاسي المسمى جھد الاختزال القیاسي H2°E مساویا 000V.0

تدفق الالكترونات من قطب الهيدروجين الى قطب النحاس , و تختزل ايونات الى فلز النحاس
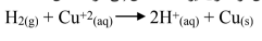
مقارنة قطب النحاس بقطب الهيدروجين .
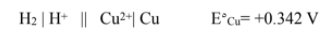
مقارنة قطب الخارصين بقطب الهيدروجين .
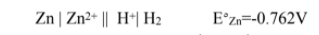
أن أیونات الھیدروجین عند قطب الھیدروجین تكتسب إلكترونات أسھل من أیونات الخارصین، لذا یكون جھد اختزال أیونات الھیدروجین أعلى من جھد اختزال أیونات الخارصین، یكون قیمة سالبة.
معادلة جھد الخلیة صفحة
Eocell = Eocathod - Eo anode
جهد الخلية القياسي = الجهد القياسي لنصف خلية الاختزال مطروحا منه الجهد القياسي لنصف خلية التأكسد .
تتدفق الالكترونات و تلقائي في الخلية الجلفانية من نصف الخلية ذات جهد الاختزال القياسي الاقل الى نصف الخلية ذات جهد الاختزال القياسي الاكبر , لتعطي جدا موجبا للخلية .
لجهد المحسوب موجب اما اذا كانت القيمة سالبة فالتفاعل غير تقائي , لكن في حالة عكس تفاعل غير تلقائي فسيكون له جهد خلية موجب , و هذا يعني ان التفاعل العكسي يكون تقائيا .
_ جهود نصف الخلية : ( حسب جهود الاختزال القياسية في الجدول 1 - 5 ص 172 )
ملاحظة هامة : سيحدث نصف التفاعل الذي له جهد اختزال اقل في اتجاه عكسي , و يصبح تفاعل اكسدة .
نصف التفاعل الذي له جهد اختزال موجب اكبر يحدث في صورة اختزال .
نصف التفاعل الذي له جهد اختزال سالب اكبر يحدث في صورة اكسدة يقاس جهد القطب تحت الظروف القياسية 25C و 1atm ويرمز له بالرمز E
البطاريات :
البطاريات خلايا جلفانية تستعمل التفاعلات التلقائية لانتاج الطاقة لاغراض متعددة .
و البطارية : عبارة عن خلية جلفانية .
خلية الخارصين و الكربون الجافة الخلية الجافة هي خلية جلفانية .
البطاريات القلوية : لقد حلت الخلية القلوية الجافة لاكثر كفاءة , محل خلية الخارصين و الكربون الجافة .
بطاريات الفضة : اصغر حجما , و تستعمل في تزويد الاجهزة بالطاقة , و منها سماعات الاذن و الساعات و آلات التصوير .
البطاریات الأویة والثانویة خلایا الخارصین والكربون، والقلویة، والفضة على أنھا بطاریات أولیة.
_ البطاریات الأولیة: ھي التي تنتج طاقة كھربائیة من تفاعل الأكسدة والاختزال الذي لا یحدث بشكل عكسي بسھولة، وتصبح البطاریة غیر صالحة للاستعمال بعد انتھاء التفاعل
_ البطاریات الثانویة: وھي تعتمد على تفاعل الأكسـدة والاختـزال العكسي، لذا فإنھ یمكن شـحنھا. فبطاریة السـیارة والحاسـوب المحمول . بطاریات التخزین التي تستعمل في آلات الحلاقة وآلات التصویر الرقمیة بطاریات نیكل – كادمیوم قابلة للشحن.
_ بطاریات تخزین المركم الرصاصي الحمضیة: تستخدم في السیارات بطاریات الرصاص الحمضیة وھو الاسم الأكثر شیوعا لھا؛ لأن المحلول الموصل في البطاریة ھو محلول حمض الكبریتیك، وھي بطاریة غیر جافة.
_ بطاریات اللیثیوم : بطاریة ذات وزن خفیف، تخزن كمیات كبیرة من الطاقة بالنسبة لحجمھا لذا ركز المھندسون انتباھھم على عنصر اللیثیـوم لسببین، ھما: أن اللیثیوم أخف فــلز معــروف، وأن لھ أقـل جھد اختزال قیاسي بالنسبـة إلى العناصر الفلزیة الأخر 40.3 -V وتستمر بطاریات اللیثیوم فترة أطول .
تستعمل عادة في الساعات والحواسیب وآلات التصویر للحفاظ على الزمن والتاریخ والذاكرة والاستعدادات الشخصیة حتى عند إطفاء الجھاز.
_ خلیة الوقود: خلیة جلفانیة وتختلف خلایا الوقود عن البطاریات الأخرى ؛ لأنھا تزود بالوقود باستمرار من مصدر خارجي.
وبسبب المصدر الخارجي فإن خلیة الوقود لا تنفد مثل سائرالبطاریات ؛ حیث تستمر في إنتاج الكھرباء ما دام الوقود متوافر .
_ التآكل : ھو خسـارة الفلـز الناتـج عن تفاعـل أكسـدة واختزال بـین الفلـز والمواد التـي في البیئـة.
لمنع التآكل ھي الجلفنة؛ إذ یتم بھا تغلیف الحدید بفلز أكثر مقاومة للتأكسد.
طرائق الحمایة من التآكل ھي: الطلاء، أو التغلیـف بفلـز آخـر، أو اسـتعمال أنود مضح.
التحليل الكهربائي :
یؤدي وجود مصدر تیار كھربائي في التحلیل الكھربائي إلى حدوث تفاعل غیر تلقائي في الخلایا الكھروكیمیائیة . ویسمى استعمال الطاقة الكھربائیة لإحداث تفاعل كیمیائي التحلیل الكھربائي.
وتسمى الخلیة الكھروكیمیائیة التي یحدث فیھا تحلیل كھربائي خلیة التحلیل الكھربائي.
فعند إعادة شحن بطاریة ثانویة مثلا فإنھا تعمل عمل خلیة تحلیل كھربائي.
تطبیقات التحلیل الكھربائي
التحـلیـل الكھربائـي للـماء و التحلیل الكھربائي لمصھور NaCl والتحلیل الكھربائي لماء البحر و إنتاج الألومنیوم و تقنیة الخامات (تقنیة الفلزات) و الطلاء بالكھرباء .
الخلاصه صفحة 192
الفصل السادس : الركبات العضوية الحيوية
البروتينات :
تؤدي البروتینات وظائف أسیاسیة تشمل تنظیم التفاعلات الكیمیائیة والدعم البنائي ونقل المواد وتقلصات العضلات .
تعـدً الإنزیـمات نوعا من البروتینـات. والبروتینات بولیمرات عضویـة تتكون من أحماضً أمینیـة مرتبطـة معا بترتیب معین والأحماض الأمینیة، كما یدل اسـمھا، جزیئات عضویة توجد فیھا مجموعة الأمین ومجموعة الكربوكسیل الحمضیة.
التركیب العام للحمض الأمیني صفحة 206
یوجد في كل حمض أمیني ذرة كربون مركزیة محاطة بأربع مجموعات: مجموعة الأمین (-NH2 (ومجموعة الكربوكسـي
COOH -وذرة ھیدروجین وسلسلة جانبیة متغیرة R.
الرابطة الببتیدیة یسـتطیع حمضان أمینیان أن یتحدا لتكوین أمید، وینطلق ماء في ھذه العملیة. ھذا التفاعل ھو تفاعل تكثف
الرابطة الببتیدیة.
الببتید: یطلق على السلسلة المكونة من حمضین أمینیین أو أكثر مرتبطةًمعا بروابط ببتیدیة.
ثنائي الببتید: الجزيء المكون من حمضین أمینیین مرتبطین معا برابطة ببتیدیة .
عدید الببتید: عشرة أحماض أمینیة أو أكثر متصلة بروابط ببتیدیة .
البروتینات: تعمل في معظـم المخلوقات الحیة عمل الإنزیمات والعوامل المحفزة للتفاعلات الكثیرة التي تحدث في الخلایا الحیة.
الإنزیم: عاملاًمحفزا حیوي حیث یعمل على تسریع التفاعل الكیمیائي دون أن یسـتھلك في ھذا التفاعل .
ویؤدي عادة إلى تخفیض طاقة تنشـیط التفاعل .
بروتینات النقل: بروتین الھیموجلوبین، الذي ینقل الأكسجین في الدم من الرئتین إلى سائر الجسـم .
الدعم البنائي: تكوین تراكیب حیویة للمخلوقات الحیـة ، البروتین البنائي الأكثر توافرا في معظم الحیوانات ھو الكولاجین , وھو جزء من الجلد والأربطة والعظام ، ومن البروتینات البنائیـة الأخرى الریش والفرو والصوف والأظفار والشعر .
الاتصالات: الھرمونات جزیئات تحمل الإشـارات من أحد أجزاء الجسـم إلى جزء آخر.
وبعض الھرمونـات بروتینـات ومنھا الأنسـولین ( الذي ینظم نسبة السكر في الدم )
– ھرمونات الغده الدرقیة - ھرمونات النمو .
الكربوهيدرات :
تزود الكربوھیدرات المخلوقات الحیة بالطاقة والمواد البنائیة .
الصیغة الجزیئیة العامة للكربوھیدرات .
الأغذیـة الغنیـة بالكربوھیـدرات الحلیـب والفواكـه والخبـز والبطاطـس. والكربوھیـدرات مركبـات عضویـة تحتوي عـلى عدة مجموعـات من الھیدروكسـیل -HO بالإضافـة إلى مجموعـة الكربونیـل الوظیفیـة (C=O )
السكریات الاحادیة: ابسط أنواع الكربوھیدرات
سكر الجلوكوز ( سكر الدم ) ، وسكر الجلاكتوز ( شبیه الجلوكوز) ، سكر الفركتوز ( سكر الفواكه)
السكریات الثنائیة: السـكروز (سكر المائدة ) یستعمل بالتحلیة ویتكون من اتحاد الجلوكوز مع الفركتوز
– اللاكتوز (سكر الحلیب ) یتكون من اتحاد الجلوكوز والجلاكتوز .
السكریات العدیدة التسكر: تتكـون من السـكریات البسـیطة وتحتوي على 12 وحـدة بناء أساسـیة أو أكثر. الجلایكوجین یتالف من وحدات الجلوكوز تختزن الطاقة وتوجد في الكبد والعضلات .
– من الأمثلة الأخرى لھا النشا والسلیلوز .
الليبيدات :
تكّون اللیبیدات الأغشیة الخلویة وتختزن الطاقة وتنظم العملیات الخلویة .
اللیبـیدات جزیئات حیویة كبیرة غیر قطبیة ، تختزن الطاقة ، تكون تركیب الاغشیة الخلویة .
اللیبیدات لیست بولیمرات إلا أن لھا وحدة بناء رئیسة مشتركة ووحدات البناء ھذه ھي الاحماض الدھنیة ، وھي أحماض كربوكسیلیة ذات سلاسل طویلة .وتحوي الصبیعیة منھا مابین 12 و 24 ذرة كربون
ویمثل تركیبھا بالصیغة .
ترتبـط ثلاثة أحمـاض دھنیـة بالجلیسرول بروابط إسـتر یتكون الجلیسرید الثلاثي
الجلیسریدات الثلاثیة صلبة أو سوائل في درجـة حـرارة الغرفـة تكون سـوائل تسـمى عـادة زیوتا. فـإذا كانـت صلبة في درجـة حرارة الغرفة تسمى دھونا.
لجزيء الصابون طرفان: طرف قطبي، وآخر غیر قطبي.
یستعمل الصابون مع الماء في تنظیف الأوساخ والزیوت غیر القطبیة؛ لأن جزیئات الأوساخ والزیوت غیر القطبیة ترتبط بالطرف غیر الً قطبي لجزیئات الصابون، في حین یكون الطرف القطبي لجزیئات الصابون قابلا للذوبان في الماء.
اللیبیدات الفوسفوریة ھناك نوع مھم آخـر من الجلیسرید الثلاثي یسمى اللیبید الفوسفوري یوجد بكثرة في الاغشیة البلازمیة .
اللیبیدات الفوسفوریة جلیسریدات ثلاثیة اسـتبدل فیھا أحـد الأحماض الدھنیة بمجموعة فوسـفات قطبیـة، تكون الجزء القطبي من الجزيء رأسـا
الشموع عبـارة عن نوع آخر من اللیبیدات تحتوي أیضا على أحماض دھنیة. والشـموع لیبیدات تتكون من اتحاد حمض دھني مع كحول ذي سلسلة طویلة
السـتیرویدات لیبیـدات تحتـوي تراكیبھـا عـلى حلقـات متعـددة الھرمونات الجنسیة- الكولسترول – فیتامین د .
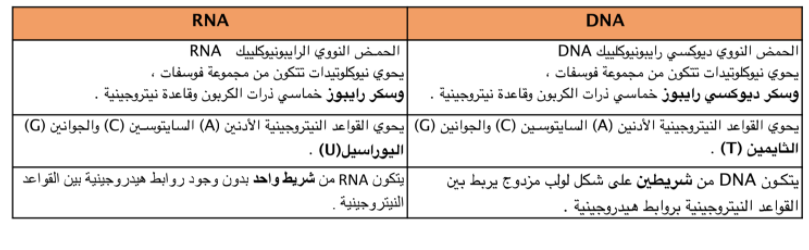
الاحماض النووية :
تخزن الأحماض النووویة المعلومات الوراثیة وتنقلھا .
والحمض النووي مبلمر حیوي یحتوي على النیتروجین، ویقوم بتخزین المعلومات الوراثیة ونقلھا.
وتسـمى وحدة البناء الأساسـیة للحمض النووي النیوكلیوتید
الأحمـاض النوویـة مبلمـرات مـن النیوكلیوتیـدات التـي تتكون مـن قاعـدة نیتروجینیـة، ومجموعة فوسفات، وسكر .
DNA و RNA ھما نوعین من الأحماض النوویة التي توجد في الخلایا الحیة .
وظیفة DNA و RNA وتقوم بتخزین المعلومات الوراثیة للخلیة في النواة .
ٍ
* مقارنة بي DNA و RNA توضح الفرق بي تركيب كل منهما :