(الضوء وطاقة الكم)
الدرس: (1-1)
اقترح رذرفورد أن شحنة نواة الذرة موجبة، وأن معظم كتلة الذرة مرتكزة في النواة المحاطة بالإلكترونات سريعة الحركة.
من عيوب نمذج رذرفورد:
- لم يوضح كيفية ترتيب الإلكترونات في الفراغ حول النواة
- لم يوضح سبب عدم انجذاب الإلكترونات السالبة للنواة الموجبة
- لم يساعد العلماء من تفسري الاختلاف والتشابه في السلوك الكيميائي للعناصر المختلفة
السلوك الكيميائي للعناصر:
- وجد العلماء انبعاث ضوء مرئي من عناصر معينة عند تسخينها بواسطة اللهب
- بني تحليل ضوء المنبعث أن هناك ارتباط بني السلوك الكيميائي للعناصر وبني توزيع الإلكترونات في ذراتها
الطبيعة الموجبة للضوء:
الإشعاع الكهرومغناطيسي: هو شكل من أشكال الطاقة الذي يسلك السلوك الموجي أثناء انتقاله في الفضاء
من أمثله:
- الضوء المرئي وهو من أنواع الإشعاع الكهرومغناطيسي والضوء له طبيعة موجية
- الأشعة الميكروويف
- الأشعة السينية
- موجات الراديو والتلفاز
خصائص الموجات:
الطول الموجي: هو المسافة بين قمتين متتاليتين أو قاعين متتاليين
- يقاس الطول الموجي بالمتر أو السنتمتر أو النانومتر
- التردد: هو عدد الموجات التي تعبر نقطة محددة خلال ثانية
يقاس التردد بوحدة الهيرتز (Hz) ويساوي موجة واحدة لكل ثانية (s/1)
- سعة الموجة: مقدار ارتفاع الموجة أو انخفاضها+
- سرعة الموجة: المسافة التي تقطها الموجة في الثانية الواحدة أثناء انتشارها
يتناسب التردد عكسياً مع الطول الموجي، فكلما زاد أحدهما قبل الآخر
الطول الموجي والتردد لا يؤثران على سعة الموجة
تختلف الموجات الكهرومغناطيسية في أطوالها الموجية وتردداتها
للموجات الكهرومغناطيسية (كالضوء مثلاً)
الطيف الكهرومغناطيسي: سلسلة من الموجات المتصلة تسري بسرعة الضوء وتختلف في التردد والطول الموجي
أمثلة: موجات الراديو ــ المايكروويف ــ الضوء المرئي ــ الأشعة فوق البنفسجية ــ أشعة X ــ أشعة جاما
- عند مرور الضوء الأبيض عبر منشور ينفصل إلى مكوناته المختلفة كطيف متصل (يسمى الطيف المرئي)
- يعتبر الطيف المرئي جزء بسيط من الطيف الكهرومغناطيسي
- تتناسب طاقة الإشعاع الكهرومغناطيسي طرديا مع التردد، فكلما زادت طاقة الإشعاع زاد التردد
- تتناسب طاقة الإشعاع الكهرومغناطيسي عكسياً مع الطول الموجي فكلما زادت طاقة الإشعاع قل الطول الموجي
ترتيب طاقة الألوان في الطيف المرئي:
الأحمر < الأصفر < الأخضر < الأزرق < النيلي < البنفسجي
- اللون البنفسجي أعلى طاقة فيكون تردد أكبر وطوله الموجي أقل
- اللون الأحمر طاقته أقل ويكون تردده أصغر وطوله الموجي أكبر
- وجد أن لكل عنصر طيف خاص به
- يتم استخدام خاصية الطيف في التعرف على مكونات الكون من نـجوم وغريها
يمكن حساب الطول الموجي والتردد من القانون:
التردد × الطول الموجي = سرعة الضوء
c = λ × ν
- العلاقة بني الطول الموجي والتردد علاقة عكسية
س / ما تردد أشعة سينية طولها الموجي mي10-10 × 1.15؟
س / إذا كان تردد أشعة الميكروويف هو H109 × 3.44 Hzفأحسب الطول الموجي لها؟
(الطبيعة المادية للضوء)
النموذج الموجي اعتبر أن الضوء موجة:
من عيوب النموذج الموجي:
- عدم القدرة على تفسير أن الأجسام تطلق ترددات محددة من الضوء عند درجات محددة
- لم يستطيع تفسير أن بعض الفلزات تطلق إلكترونات عندما يسقط عليها ضوء بتردد معين (ظاهرة التأثير الكهروضوئي)
الطبيعة المادية للضوء:
هو تشع الأجسام ضوء عند تسخينها
تتوهج قطعة الحديد الرمادية عند تسخينها باللون الأحمر ثم تتحول إلى اللون البرتقالي ثم إلى اللون الأزرق
كلما سخن الحديد أصبحت طاقته أكبر ويبعث ألوان مختلفة من الضوء ذات ترددات وأطول موجبة مختلفة لم يستطيع النموذج الموجي تفسير انبعاث هذه الأطوال الموجية المختلفة
كان العالم (ماكس بلانك) يدرس الضوء المنبعث من الأجسام الساخنة، وتوصل إلى أن المادة يمكن أن تكسب أو تخسر طاقة على دفعات بكميات صغيرة تسمى الكم
الكم: هو أقل كمية من الطاقة يمكن أن تكتسبها الذرة أو تفقدها
س / لماذا يتغير لون الأجسام الساخنة تبعاً لدرجة حرارتها؟
لأن الحرارة تؤدي إلى تغير الطاقة وبالتالي تغير تردد الضوء المنبعث وطوله الموجي لذا نراه بألوان مختلفة
توصل ماكس بلانك إلى وجود علاقة بين الطاقة المنبعثة من الأجسام (طاقة الكم) وترددها:
E = h v
حيث أن: E (طاقة الإشعاع)
h ثابت بلانك (jsن34-10 × 6،626)
v تردد الإشعاع
كلما زادت الطاقة زادت الطاقة زاد التردد
تشع المادة أو تمتص طاقة (مكمأة) بمضاعفات كاملة لقيم h v مثل 3h v . 2hv
التأثير الكهروضوئي:
هو انبعاث الإلكترونات (الفوتو إلكترون) من سطح لفلز عندما يسقط عليه الضوء يتردد مساو لتردد الفوتون أو أعلى منه
بزيادة الطاقة (التردد) تؤدي إلى زيادة الإلكترونات المنطلقة
الطبيعة الثنائية للضوء:
افترض أينشتاين أن للضوء خاصية موجية ومادية، وأن الضوء حزمة من الطاقة تسمى فوتون.
الفوتون: جسيم لا كتلة له يـحمل كما من الطاقة
حساب طاقة الفوتون: E p h = h v
وحدة الطاقة: الجول J
طاقة الفوتون تعتمد على تردده
س / ما طاقة فوتون الجزء البنفسجي لضوء الشمس إذا كان تردده (70230s11014)ه? (h = 6.626×1034)
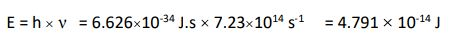
س / فوتون يمتلك طاقة مقدارها Jب25-10 ×2.93
س / ما طاقة فوتون موجات الميكروويف الذي طوله الموجي 0.125m ?
طيف الانبعاث
طيف الانبعاث الذري للعنصر: هو مجموعة من ترددات الموجات الكهرومغناطيسية المنطلقة من العنصر
يتكون طيف الانبعاث من عدة خطوط منفصلة من الألوان
لكل عنصر طيف انبعاث ذري خاص ومميز يستخدم للتعرف على العنصر
طيف الامتصاص: هو امتصاص العناصر ترددات محددة من الضوء التي تظهر كأنها خطوط سوداء
نمذج بور للذرة
اقترح بور أن للذرة مجالات طاقة معينة يسمح للإلكترونات أن توجد فيها
اقترح بور أن الإلكترونات تتحرك حول النواة في مدارات دائرية
اقترح بور أن طاقة المدار تزداد كلما كبر مدار الإلكترون، وتقل كلما صغر مدار الإلكترون
خصص بور لكل مدار عدد صحيح يسمى عدد الكم n
حالات الذرة:
حالة الاستقرار للذرة: هي الحالة التي تكون فيها إلكترونات الذرة في أدنى طاقة
حالة الإثارة للذرة: عندما تكتسب الذرة طاقة
- عند إثارة الذرة تمتص الإلكترونات طاقة فتنقل إلى المدارات الأعلى في الطاقة
- نتيجة وجود مدارات مختلفة فهناك أكثر من احتمال لانتقال الإلكترون
اقترح بور أن الذرة عندما مستقرة لا تشع ضوء ولكن عند إضافة طاقة إليها فإن الإلكترونات تنتقل إلى المجالات الأعلى
وتصبح مثارة، وعندما ترجع الإلكترونات إلى المجال الأقل في الطاقة تطلق فوتون له طاقة على شكل ضوء تساوي الفرق بين المستوين
طاقة الفوتون = الفرق بني المستوي الأعلى والأدنى = طاقة الفوتون = h v
طيف ذرة الهيدروجين:
تتكون ذرة الهيدروجين من إلكترون واحد يوجد في مستوى الطاقة الأول 1=n
لذرة الهيدروجين حالات إثارة كثرية، رغم أنها تحتوي على الكرتون واحد
مستويات الطاقة في ذرة الهيدروجين تبتعد عن بعضها مسافات غري متساوية
سلاسل الطيف للهيدروجين:
ليمان: عند انتقال الإلكترونات إلى المستوى الأول n = 1
وصفها: فوق بنفسجية



