الدرس الأول: التغيرات الكيميائية
ذرات المواد ترتبط مع بعضها وعندما مع ذرات أخرى
تتكون الرابطة الكيميائية
الرابطة الكيميائية: قوة تجعل الذرات تترابط معا
تفكيك الروابط وتكوينها يغر الخصائص الكيميائية للمادة
مثال: عندما يحترق الفحم فإن جزيئات الأكسجين في الهواء تترابط مع ذرات الكربون ثاني أكسيد الكربون
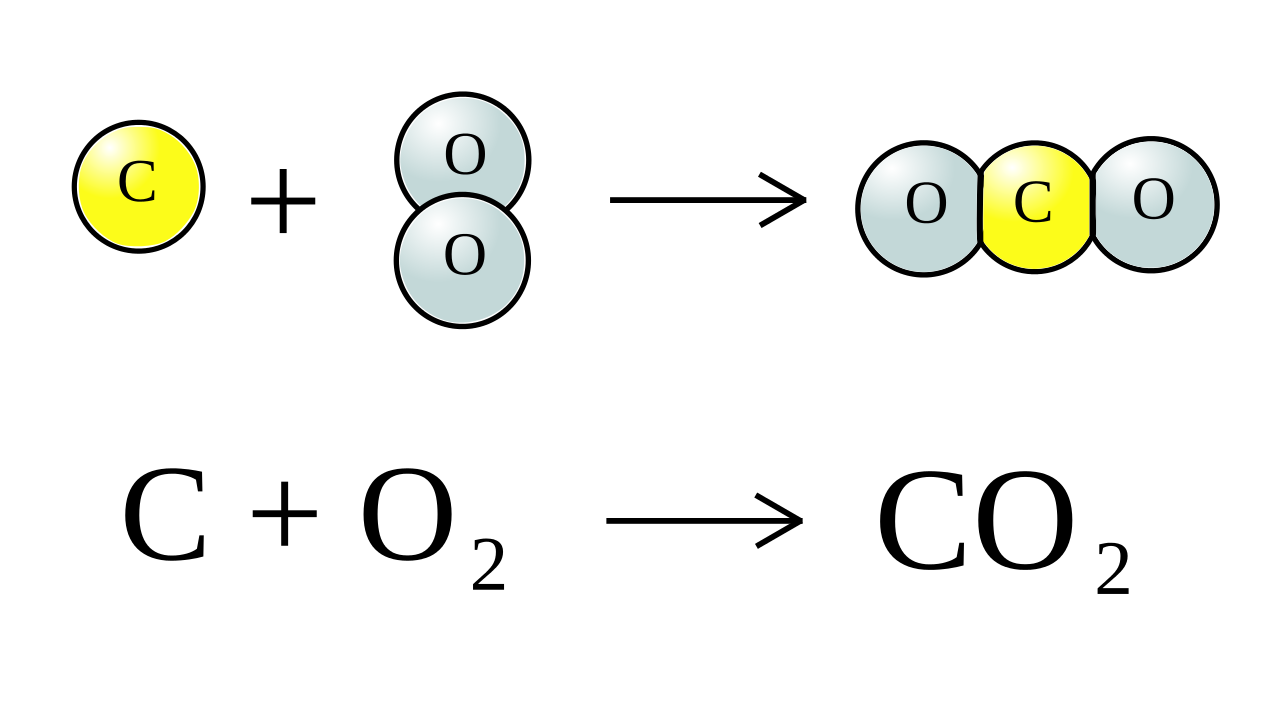
التغير الكيميائي: تغير ينتج عنه مواد جديدة, لها خصائص كيميائية تختلف عن خصائص المواد الأصلية
تغير اللون، تصاعد الغازات، انطلاق الحرارة أو الضوء
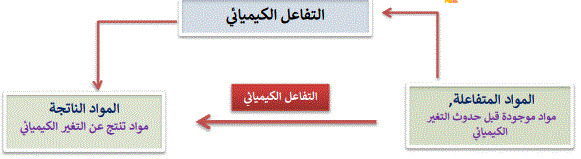
المعادلة الكيميائية
وصف التفاعل الكيميائي بصورة رمزية كميات
المواد المتفاعلة والمواد الناتجة
ويفصل السهم بينهما
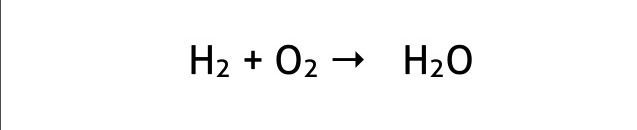
التفاعلات الكيميائية:
1- تفاعل الاتحاد: يحدث عندما ترتبط عناصر أو مركبات معا لتكوين مركبات جديدة اكثر تعقيداً
مثل: التفاعل الذي يستخدم في الصناعة لإنتاج المواد الكيميائية عامة
2- التحلل الكيمائي: تتفكك مركبات معقدة إلى مواد أبسط منه
مثل: التحلل الذي يحدث يوميا في أجسامنا
3- تفاعل الإحلال: يحدث عندما تتبادل العناصر أو الجزيئات أماكنها مكونا مركبا جديداً
مثل: تفاعل حمض الهيدروكلوريك مع هيدروكسيد الصوديوم لتكوين الماء وكلوريد الصوديوم ملح الطعام
تعتمد سرعة التفاعل الكيميائي على
(درجة الحرارة – التركيز– الضغط – زيادة درجة الحرار)
التفاعل الطارد للطاقة:
تفاعلات كيميائية تطلق طاقة
مثال: حرارة وضوء
التفاعل الماص للطاقة:
تفاعلات تحتاج إلى مصدر
مثال: عملية البناء الضوئي (لا تحدث دون تزويدها بطاقة من مصدر ضوئي)
الدرس الثاني: الخصائص الكيميائية
الخصائص الكيميائية
اولاً: الفلزات
تقع الفلزات في الجانب الأيسر من الجدول الدوري
خصائصها: لها لمعان – قابلة للثني بسهولة – موصلة للحرارة والكهرباء
تصنف الفلزات إلى ثالث فئات:
1- فلزات قلوية: تقع في الجانب الأيسر البعيد من الجدول الدوري الصوديوم – الليثيوم – البوتاسيوم
خصائصها: ناعمة الملمس – نشيطة جدا – لا توجد منفردة في الطبيعة
2- فلزات قلوية ترابية: تقع يمين العناصر القوية
الكالسيوم – الماغنيسيوم
خصائصها: خفيفة ولينة - أقل نشاطا من الفلزات القلوية
3- فلزات انتقالية: تقع في وسط الجدول الدوري
النحاس الحديد الذهب النيكل الزنك
خصائصها: قاسية – لها لمعان (بريق) تستعمل لصنع النقود والمجوهرات والآلات
ثانياً: أشباه الفلزات واللافلزات
تقع أشباه الفلزات واللافلزات في الجانب الأيمن من الجدول الدوري
منها البورون – السيلكون – الزرنيخ
خصائصها: شبه موصلة للكهرباء
ثالثاً: اللافلزات
منها الأكسجين - الكربون - النيتروجين
خصائصها: يوجد معظمها عند درجة حرارة الغرفة في صورة غازات أو مواد صلبة هشة سهلة الانكسار لا توصل الحرارة والكهرباء
الغازات النبيلة: تقع في العمود الأخير إلى الجهة اليمنى لا تتفاعل مع العناصر الأخرى
مثل: الأرجون– النيون – الزنون – الهيليوم

الهالوجينات: تقع في عمود يسار الغازات النبيلة
مثل: الفلور – الكلور. الأحماض القواعد

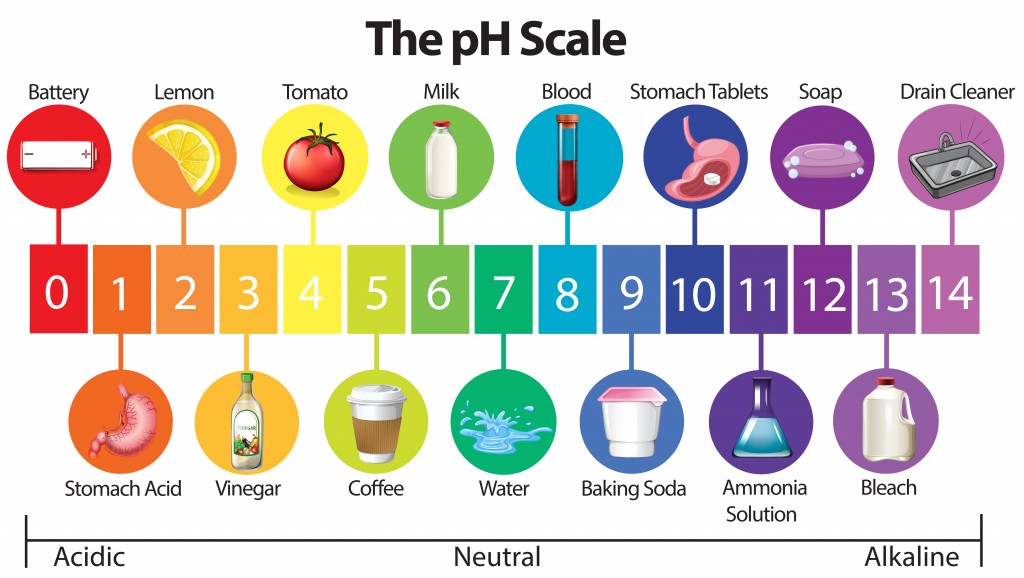
الكواشف: مواد خاصة يتغير لونها عند وجود الحمض أو القاعدة
كتغير لون ورقة تباع الشمس وعصري الكرنب
القواعد: ذات طعم مر ملمسها صابون تحول ورقة تباع الشمس الحمراء إلى زرقاء
المواد التي لها رقم هيدروجيني أكثر من 7 تكون قواعد
الأحماض: مواد حارقة ذات طعم لاذع, تتفاعل مع الفلزات مكونة غاز الهيدروجين تحول ورقة تباع الشمس الزرقاء إلى حمراء
المواد التي لها رقم هيدروجيني أقل من 7 تكون أحماض
استعمالات الأحماض والقواعد:
1- تستعمل القواعد القوية في البطاريات تستعمل الأمونيا في التنظيف وقرص الألوان
2- تستعمل الأحماض القوية لإنتاج البلاستيك والأنسجة وأكثرها استعمالاً
الكبريتيك - الستريك - الهيدروكلوريك.
خصائص الأملاح:
1- حمض الهيدروكلوريك من المواد الخطرة وهيدروكسيد الصوديوم مادة قاعدية خطيرة عند خلطهما معا ينتج ملح الطعام كلوريد
2- الملح: مركب ناتج عن تفاعل حمض وقاعدة, يسمى التفاعل الذي يتم عند خلط حمض مع قاعدة التعادل, وينتج عنه ملح وماء



