حل الفصل الرابع الاتزان الكيميائي كتاب كيمياء 3 للمرحلة الثانوية و حلول كتاب الكيمياء 3 المرحلة الثانوية للعام الدراسي 1442 هـ.
يتضمن الفصل الرابع ثلاثة دروس هي على الترتيب: حالة الاتزان الديناميكي - العوامل المؤثرة في الاتزان الكيميائي - استعمال ثوابت الاتزان، بالإضافة إلى تقويم الفصل.
الفصل الرابع الاتزان الكيميائي
نكمل معكم باستعراض حلول الفصل الرابع في حل كتاب كيمياء 3 مقررات ثانوي وهو رابع فصول الكتاب لهذا الفصل الدراسي.
حل درس حالة الاتزان الديناميكي

مسائل تدريبية
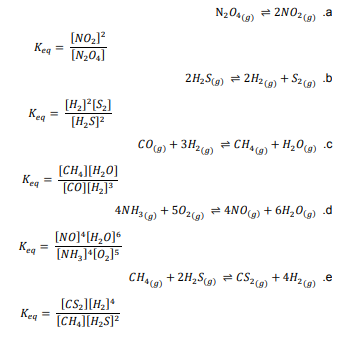
السؤال : اكتب تعابير ثابت الاتزان للمعادلات الآتية :
الجواب :
السؤال : تحفيز اكتب المعادلة الكيميائية التي تمثل تعبير الاتزان الآتي :
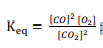
الجواب :
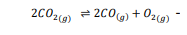
مسائل تدريبية
السؤال : اكتب تعبير ثابت الاتزان غير المتجانس لكل مما يلي :
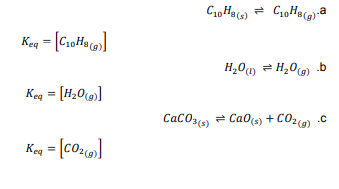
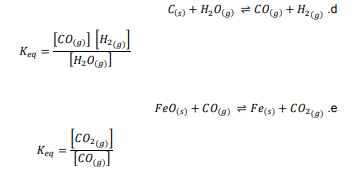
السؤال : تحفيز يتفاعل الحديد الصلب مع غاز الكلور لتكوين كلوريد الحديد III FeCl I3 . اكتب معادلة كيميائية موزونة وتعبير ثابت الاتزان للتفاعل .
الجواب :
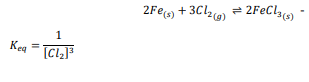
مسائل تدريبية
السؤال : احسب قيمة Keq للاتزان N2O4(g) ----- 2NO2(g) إذا علمت ان
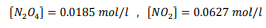
الجواب :
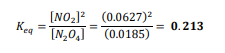
السؤال : احسب قيمة Keq للاتزان
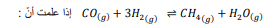
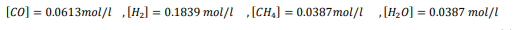
الجواب :
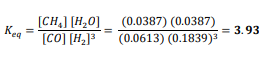
السؤال : تحفيز يصل التفاعل
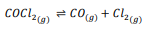
إلى حالة الاتزان عند درجة حرارة 900K
فإذا كان تركيز Co و CL2 هو M 0.150 عند الاتزان فما تركيز CoCL2 ؟ علما ان ثابت الاتزان Keqعند درجة الحرارة نفسها يساوي 8.2 ×10-2
الجواب :
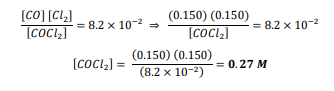
التقويم 1ــ4
السؤال : فسر كيف ترتبط قيمة ثابت الاتزان مع كمية النواتج Keq ؟
الجواب : كلما زادت قيمة ثابت الاتزان زادت كمية المواد الناتجة المتكونة عند الاتزان .
السؤال : قارن بين الاتزان المتجانس والاتزان غير المتجانس .
الجواب :
الالتزان المتجانس تكون فيه المتفاعلات والنواتج موجودة في نفس الحالة الفيزيائية
أما الاتزان غير المتجانس تكون فيه المتفاعلات والنواتج توجد في أكثر من حالة فيزيائية واحدة .
السؤال : عدد ثلاث خواص يجب أن توجد في خليط تفاعل ليصل إلى حالة اتزان .
الجواب :
1 -يجب أن يكون مزيج التفاعل في وعاء مغلق .
2 -يجب أن تبقى درجة الحرارة ثابتة .
3 -يجب أن توجد النواتج والمتفاعلات معاً في الوعاء نفسه .
السؤال : احسب قيمة Keq عند درجة حرارة 400 k للتفاعل الآتي
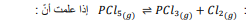
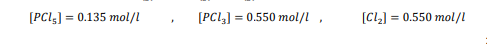
الجواب :
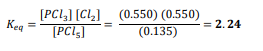
السؤال : فسر البيانات يوضح الجدولآتي قيم ثابت الاتزان عند ثلاث درجات حرارة مختلفة . في أي منها يكون تركيز النواتج أكبر ؟ فسر إجابتك .
| 263k | 273k | 373k |
| 0.0250 | 0.500 | 4.500 |
الجواب : يكون تركيز النواتج أكبر عند درجة الحرارة k373 ، بما أن المواد الناتجة في بسط المعادلة لذا فكلما زادت قيمة Keq زاد تركيز المواد الناتجة .
حل درس العوامل المؤثرة في الاتزان الكيميائي

التقوم 4-1
السؤال : فسر كيف يستجيب النظام في حالة الاتزان إلى الجهد ؟ واذكر العوامل التي تؤثر في نظام متزن .
الجواب : تبعا لمبدأ لوتشاتلييه فإنه عندما يبذل جهد على نظام متزن فإن ذلك يؤدي إلى إزاحة النظام في الاتجاه الذي يخفف من أثر هذا الجهد.
من العوامل التي تؤثر في نظام متزن :
1- التغير في التركيز
2- التغير في الحجم والضغط
3 -درجة الحرارة
السؤال : فسر كيف يؤثر تقليل حجم وعاء التفاعل في كل نظام اتزان مما يأتي ؟
a. 2𝑆𝑂2(𝑔) + 𝑂2(𝑔) ⇌ 2𝑆𝑂3(𝑔)
الجواب :
عدد مولات الغاز المتفاعل 3 بينما عدد مولات الغاز الناتج 2.
لذلك يؤثر تقليل حجم الوعاء على هذا النظام المتزن فيحدث إزاحة للاتزان جهة اليمين فيتكون المزيد من 3𝑆𝑂
b. 𝐻2(𝑔) + 𝐶𝑙2(𝑔) ⇌ 2𝐻𝐶𝑙(𝑔)
الجواب :
عدد مولات الغاز المتفاعل = 2 وعدد مولات الغاز الناتج = 2
عدد مولات الغاز المتفاعل = عدد مولات الغاز الناتج لذلك فإن تغير الحجم لا يؤثر على اتزان النظام .
السؤال : قرر ما إذا كان رفع درجة الحرارة أو خفضها ينتج المزيد من CH3CHOفي معادلة الاتزان الآتية :
𝐶2𝐻2(𝑔) + 𝐻2𝑂(𝑔) ⇌ 𝐶𝐻3𝐶𝐻𝑂(𝑔) 𝛥𝐻° = −151 𝐾𝐽
الجواب : قيمة 𝛥𝐻° سالبة . لذا يعد التفاعل طارد للحرارة ، وهذا يعني أنه انطلقت الحرارة على صورة نواتج , ويؤدي تناقص النواتج ( خفض درجات الحرارة ) إلى انزياح التفاعل نحو اليمين لإنتاج مزيد من المواد الناتجة . لذا سينتج المزيد من 𝐶𝐻3𝐶𝐻𝑂 عند خفض درجة الحرارة .
السؤال : وضح يظهر الجدول تراكيز مادتين AوB في خليطي تفاعل ، يتفاعلان حسب المعادلة
B ⇌ 2A
200 . 𝐾𝑒𝑞 = هل المزيجان عند موضعي اتزان مختلفين ؟
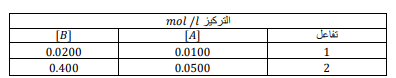
الجواب : نحسب 𝐾𝑒𝑞 في كلا الحالتين :

السؤال : صمم خريطة مفاهيمية توضح طرائق تطبيق مبدأ لوتشاتلييه لزيادة النواتج في نظام اتزان وزيادة المتفاعالت في النظام نفسه .
الجواب :
| العوامل المؤثرة | حالة الاتزان |
| إضافة عوامل مساعدة ( حفازات ) | لا تتأثر |
| زيادة تراكيز المواد المتفاعلة . | ينزاح في الاتجاه المباشر |
| زيادة تراكيز المواد الناتجة | ينزاح في الاتجاه العكسي |
| نقصان تراكيز المواد المتفاعلة | ينزاح في الاتجاه العكسي |
| نقصان تراكيز المواد الناتجة | ينزاح في الاتجاه المباشر |
| زيادة الضغط | ينزاح في الاتجاه ذي عدد المولات الغازية الاقل في حالة تساوي عدد المولات لا يتأثر |
| انخفاض الضغط | ينزاح في االتجاه ذي عدد المولات الغازية الاكبر في حالة تساوي عدد المولات لا يتأثر |
| زيادة درجة الحرارة | التفاعل ناشر للحرارة ينزاح في الاتجاه العكسي لتفاعل ماص للحرارة ينزاح في الاتجاه المباشر |
| انخفاض درجة الحرارة | التفاعل ناشر للحرارة ينزاح في الاتجاه المباشر لتفاعل ماص للحرارة ينزاح في الاتجاه العكسي |
لزيادة النواتج نجعله يتجه في الاتجاه المباشر .
ولزيادة المتفاعلات نجعله يتجه في الاتجاه العكسي
حل درس استعمال ثوابت الاتزان

مسائل تدريبية
السؤال : ينتج الميثانول عن تفاعل أول أكسيد الكربون مع الهيدروجين
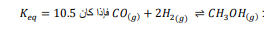
عند درجة حرارة محددة ، فاحسب التراكيز الآتية :
الجواب :

السؤال : تحفيز في التفاعل العام

إلى أن يصلا إلى حالة اتزان . فإذا كان تركيز A عند الاتزان0.450 mol/l ، فما تركيز المواد الأخرى عند الاتزان ؟ وما قيمة Kep ؟
الجواب : بداية نحسب تراكيز المواد عند الاتزان :

مسائل تدريبية
السؤال : استعمل البيانات في الجدول 3ـ4 لحساب الذوبانية المولارية mol/l ، للمركبات الأيونيةالآتية عند درجة حرارة K 298
1- PbCrO4
2- AgCl
3- CaCaO3
الجواب : نكتب المعادلة الموزونة لكل تفاعل ثم نحسب المولارية
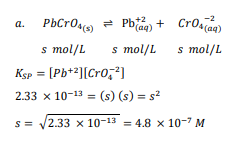
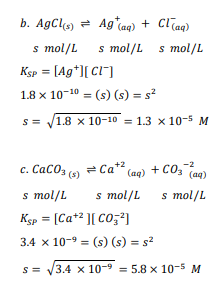
السؤال : تحفيز إذا علمن ان ksp لكربونات الرصاص pbCO3 يساوي 7.40×10 عند k 298 فما ذوبانية كربونات الرصاص g/l ؟
الجواب : نحسب الذائبية ب l/mol وثم نحولها إلى g/l بالضرب ب الكتلة المولية لكربونات الرصاص :
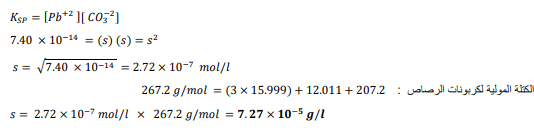
مسائل تدريبية
السؤال : استعمل قيم ksp الموجودة في الجدول 3 ـ4 لسحاب :
الجواب :
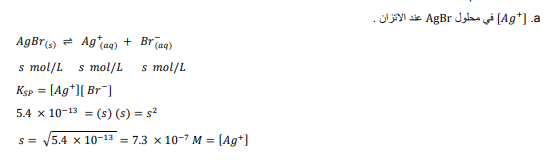

السؤال : احسب ذوبان Ag3Po4 (ksp = 2.6×10 )
الجواب :
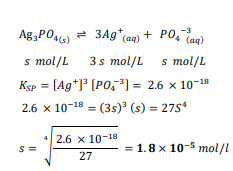
السؤال : تحفيو ذوبان كلوريد الفضة AgCL=1.86×10 g/100g في الماء عند درجة حرارة 298 K
احسب AgCL ل Ksp
الجواب :

مسائل تدريبية
السؤال : استعمل قيم Ksp من الجدول 4-3 لتتوقع ما إذا سيتكون راسب عند خلط كميات متساوية من المحاليل الآتية :
الجواب :

السؤال : تحفيز هل يتكون راسب عند إضافة 250 ml من 0.20M Mg Cl2 إلى 750mlمن 0.0025 M NaOH
الجواب :

التقويم 4-3
السؤال : اكتب المعلومات التي تحتاج إليها لحساب تركيز ناتج في خليط التفاعل عند الاتزان .؟
الجواب : سنحتاج إلى : تراكيز المتفاعلات ، وتراكيز النواتج جميعها، و Ksp
السؤال : فسر كيف تستخدم ثابت حاصل الذوبانية في حساب ذوبانية مركب أيوني قليل الذوبان ؟
الجواب : نكتب معادلة التفاعل عند االتزان وتعبير ثابت حاصل الذوبان ، لتساوي قيمة S الذائبية المولية للمركب . ونستبدل مضاعفات s المناسبة في تعبير ثابت حاصل الذوبان ، ثم نجد قيمة s.
السؤال : صف كيف يقلل وجود الايون المشترك ذوبانية المركب الأيوني ؟
الجواب : يقلل الأيون المشترك الذائبية بتحول اتجاه الاتزان نحو المادة الصلبة الراسبة .
السؤال : وضح الفرق بين Ksp و Qspهل يعد Qsp ثابت اتزان ؟
الجواب : يعد Qsp حاصل ضرب تراكيز الايونات التي يمكن ان تكون موجودة في محلول مركب أيوني و تقاس قيمته للمقارنة بقيمة Ksp التي تعبر عن حاصل ضرب تراكيز الايونات الموجودة فعليا في محلول مشبع بحيث يعد Ksp ثابت الازان في حين لا يعد Qsp ثابت الاتزان
السؤال :احسب ذوبانية كربونات الماغنسيوم 3 𝑀𝑔𝐶𝑂في الماء النقي إذا كان Ksp يساوي 10 × 6.2
الجواب :
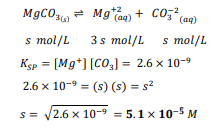
السؤال : صمم تجربة اعتماداً على الذوبانية لتوضح أي الأيونين Mg+2 أو Pb+2 يوجد في محلول مائي ؟
الجواب : بما أن كرومات الماغنسيوم ذائبة ، وكرومات الرصاص غير ذائبة ، لذا نضيف 0.10 ml من محلول كرومات البوتاسيوم تركيزه 0.100M إلى 100.0ml من محلول مائي غير معروف . فإذا احتوى المحلول المجهول على أيون الماغنسيوم ، فلن يتكون راسب من 4. 𝑀𝑔𝐶𝑟𝑂 أما إذا احتوى المجهول على أيون الرصاص II فسوف تترسب 4 𝑃𝑏𝐶𝑟𝑂الصلبة الصفراء اللون .
حل تقويم الفصل الرابع الاتزان الكيميائي

إتقان المفاهيم
السؤال : صف حالة اتزان تحدث في الحياة اليومية بين عمليتين متعاكستين ؟
الجواب : تسخين الماء في إناء مغلق فيتبخر الماء ثم يتكثف مرة أخرى ويعود سائل .
السؤال : إذا قيل لك إن تركيز المتفاعلات والنواتج لاتتغير فلماذا تستعمل كلمة ديناميكي لوصف الاتزان الكيميائي ؟
الجواب : تستعمل كلمة ديناميكي لوصف الاتزان الكيميائي لوجود تفاعلين عكسيين يجريان بنفس السرعة .
السؤال : هل المعادلة الآتية تمثل اتزانا متجانسا أم غير متجانس ؟ فسر إجابتك ؟ 𝐻2𝑂(𝑠) ⇌ 𝐻2𝑂(𝑙)
الجواب : تمثل المعادلة اتزاناً غير متجانس ، لأن المتفاعلات والنواتج متمثلة في أكثر من حالة فيزيائية .
السؤال : ما المقصود بموضع الاتزان ؟
الجواب : هي النقطة التي عندها يوازن التفاعل الامامي والعكسي إحداهما الآخر .
السؤال : وضح كيفية كتابة تعبير ثابت اتزان .؟
الجواب : نسبة تراكيز النواتج إلى نسبة تراكيز المتفاعلات وكل تركيز مرفوع إلى قوة تمثل معاملها في المعادلة الموزونة .
السؤال : لماذا يجب أن تعير انتباهك للحالات الفيزيائية للنواتج والمتفاعلات عند كتابة تعابير ثابت الاتزان ؟
الجواب : لأن الاتزان قد يحتوي على حالات غازية وصلبة وسائلة ، فيتم إزالة المواد السائلة, المواد الصلبة النقية من تعبير ثابت الاتزان .
السؤال : لماذا تعني قيمة Keq الكبيرة ان النواتج مفضلة في نظام الاتزان ؟
الجواب : تعبر قيمة Keq الكبيرة عددياً على ان تركيز النواتج الموجودة في البسط أكبر من تراكيز المتفاعلات الموجودة في المقام
السؤال : ماذا يحدث لـ Keq لنظام متزن ، إذا تم إعادة كتابة معادلة التفاعل بطريقة عكسية ؟
الجواب : تكون القيمة الجديدة لـ Keq هي مقلوب قيمتها الاصلية 1/ Keq
السؤال : كيف لنظام الاتزان أن يحتوي على كميات صغيرة وغير متغيرة من النواتج ، وفي الوقت نفسه يحتوي على كميات كبيرة من المتفاعلات ؟ كيف يمكن ان تبرز Keq لمثل هذا الاتزان
الجواب :
يحدث مثل هذا الاتزان إذا تفاعلت النواتج الاولية المتكونة بسرعة لدرجة تصبح معها سرعة التفاعل العكسي مساوية لسرعة التفاعل الامامي . ويجب ان تكون قيمة Keq لمثل هذا الاتزان
ولا تتغير تراكيز المتفاعلات والنواتج ، حيث يمر كل جزيء من المتفاعلات والنواتج بتغير كيميائي عندما تتساوى سرعة التفاعلين الامامي والعكسي .
إتقان حل المسائل
السؤال : اكتب تعبير ثابت الاتزان لكل اتزان متجانس فيما يأتي :
الجواب :
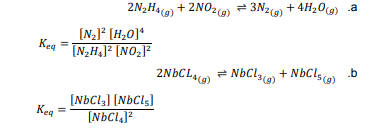
السؤال : افترض أن لديك مكعباً من فلز المنجنيز النقي طول ضلعه 5.25cm وكتلته تساوي g 6.1076 ، فما التركيز المولاري للمنجنيز في المكعب ؟
الجواب :

السؤال : قيمة Keq للتفاعل C ⇌ +B2 + 𝐴 + تساوي 63.3 ، يوضح الجدول 3ــ4 تراكيز المتفاعلات والنواتج في خليط تفاعلين عند درجة الحرارة نفسها . حدد ما إذا كان التفاعلان في حالة اتزان .
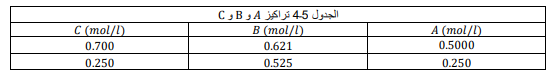
الجواب :

إتقان المفاهيم
السؤال : ما المقصود بالشغل المبذول على تفاعل ما عند الاتزان ؟
الجواب : هو أي تغير يؤثر في اتزان التفاعل( إزاحة اتجاه الاتزان نحو اليمين أو اليسار ) ، أي هو تغير في ( التركيز ، الحجم ، الضغط ، درجة الحرارة )
السؤال : كيف يصف مبدأ لوتشاتلييه استجابة الاتزان للإجهاد ؟
الجواب : ينص مبدأ لوتشاتلييه على أن الاتزان ينزاح في الاتجاه الذي يقلل من التأثير الواقع عليه
السؤال : لماذا يسبب إزالة المتفاعل إزاحة الاتزان نحو اليسار ؟
الجواب : لكي نعيد نسبة الاتزان للمتفاعلات والنواتج ، ينزاح الاتزان نحو المتفاعلات ( نحو اليسار )
السؤال : عند إزاحة الاتزان نحو اليمين ، ماذا يحدث لكل من :
a .تركيز المتفاعلات
b .تركيز النواتج .
الجواب : يقل تركيز المتفاعلات ، في حين يزداد تركيز النواتج .
السؤال : كيف يمكن للتغيرات الآتية التأثير في موضع الاتزان للتفاعل المستعمل لإنتاج الميثانول من أول أكسيد الكربون والهيدروجين ؟
𝐶𝑂(𝑔) + 2𝐻2(𝑔) ⇌ 𝐶𝐻3𝑂𝐻(𝑔) + حرارة
أ- إضافة CO
ب- خفض درجة الحرارة
ج- إضافة عامل محفز
د- إزالة CH3OH
ي- تقليل حجم وعاء التفاعل
الجواب :
أ- ينزاح التفاعل نحو اليمين
ب- ينزاح التفاعل نحو اليمين .
ج- لا ينزاح الاتزان نحو أي اتجاه
د- ينزاح التفاعل نحو اليمين .
ي- ينزاح التفاعل نحو اليمين .
السؤال : المشروبات الغازية استعمل مبدأ لوتشاتلييه لشرح كيف أن إزاحة الاتزان الآتي :
𝑃𝐶𝑙 (𝑔) ⇌ 𝑃𝐶𝑙3(𝑔) + 𝐶𝑙2(𝑔) + حرارة
الجواب : تميل عملية التسخين إلى تفضيل التفاعل العكسي( الماص للحرارة ) وذلك بتحويل الاتزان نحو اليسار .
السؤال : إذا أضيف مذيب سائل من الكلور إلى دورق يحتوي تفاعل الاتزان الآتي
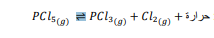
فكيف يتاثر الاتزان نحو اليمين لتعويض غاز الكلور الذي يذوب ؟
الجواب : يتجه الاتزان نحو اليمين لتعويض غاز الكلور الذي يذوب
السؤال : إذا أعطيت التفاعلين الآتيين عند الاتزان ؟
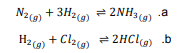
فسر لماذا يسبب تغير حجم وعاء التفاعلين تغير موضع الاتزان ل a ولا يؤثر في b ؟
الجواب : في المعادلة a يختلف عدد مولات الغاز للمتفاعلات والنواتج في المعادلة ، في حين يتساوى عدد مولات الغاز على طرفي المعادلة b. فعندما يتساوى عدد مولات الغاز على طرفي المعادلة فلن يكون لتغير الحجم أي تأثير في الاتزان .
السؤال : هل تتوقع أن تزداد أو تقل قيمة Keq العددية عند زيادة درجة الحرارة في الاتزان الآتي : فسر إجابتك .
𝑃𝐶𝑙5(𝑔) ⇌ 𝑃𝐶𝑙3(𝑔) + 𝐶𝑙2(𝑔) + حرارة
الجواب : ستقل قيمة Keq العددية عند زيادة درجة الحرارة و ذلك لأن زيادة درجة الحرارة ستؤدي إلى إزاحة الاتزان نحو اليسار و يقل تركيز النواتج فتقل قيمة Keq
السؤال : فسر كيف يمكن أن تنظم الضغط لتعزز تكوين النواتج في نظام الاتزان الآتي :
𝑀𝑔𝐶𝑂3(𝑠) ⇌ 𝑀𝑔𝑂(𝑠) + 𝐶𝑂2
الجواب : عندما نقلل الضغط على التفاعل فإن الحجم يزداد فيقل تركيز CO2 في الإناء مما يؤدي إلى إزاحة الاتزان جهة اليمين ليزيد من تكوين النواتج حيث أن هذا التفاعل لا يوجد به غازات سوى CO2 في النواتج أما المتفاعلات فهي مادة صلبة.
السؤال : تفاعل الإيثيلين C2H4مع الهيدروجين لإنتاج الايثان C2H6وفق المعادلة :
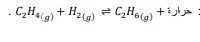
كيف يمكنك تنظيم درجة الحرارة لهذا الاتزان لكي :
a .تزيد كمية الإيثان الناتج .
b .تقلل تركيز الإيثيلين .
c .تزيد كمية الهيدروجين في وعاء التفاعل .
الجواب :
a .خفض درجة الحرارة
b .خفض درجة الحرارة .
c .رفع درجة الحرارة .
3ــ4إتقان المفاهيم
السؤال : ماذا تعني بقولك إن لدى محلولين أيوناً مشتركاً ؟ اذكر مثالا يوضح ذلك
الجواب : إذا كان في المحلولين أيون مشترك ، فإن ذلك يعني أن كليهما يحتوي على الأيون نفسه .
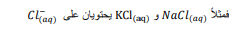
السؤال : لماذا لا تعطى بعض المركبات مثل كلوريد الصوديوم قيم Ksp ؟
الجواب : إذا أعطيناها قيمة Ksp ستكون عددا كبيرا . حيث ان هذه المركبات ومنها كلزريد الصوديوم له ذوبانية عالية في الماء فعند ذوبانها في الماء تتفكك جميعا إلى أيونات و اما ثوابت حاصل الذوبانية فهي تقاس للمركبات قليلة الذوبان . إذا اعطيناها قيمة Ksp ستكون عددا كبيرا
السؤال : الأشعة السينية لماذا يعد استعمال كبريتات الباريوم أفضل من كلوريد الباريوم عند التعرض للأشعة السينية ؟ علما انه عند درجة حرارة 26 درجة فإن 37.5 من 𝐵𝑎𝐶𝑙يمكن ان تذوب في 100 ml من الماء ؟
الجواب : تعد أيونات الباريوم مادة سا مة للإنسان , لكن كبريتات الباريوم يمكن تناولها بأمان ، لأن ذوبانيتها منخفضة جداً ، أما كلوريد الباريوم فله ذائبية عالية , لذلك يجعل تناوله في غاية الخطورة
السؤال : فسر ما يحدث في الشكل 43ــ4 اعتماداً على Ksp و Qsp .
الجواب : سيتكون راسب لان Ksp < Qsp
السؤال : صف المحلول الناتج عن خلط محلولين لهما Ksp = Qsp . هل يتكون راسب ؟
الجواب : سوف يكون المحلول الجديد مشبعاً ، ولن يتكون راسب .
إتقان المسائل
السؤال : اكتب Ksp لكرومات الرصاص 4 𝑃𝑏𝐶𝑟 O و احسب ذوبانية بوحدة MOL/L علما ان 𝐾𝑆𝑃 = 2.3 × 10
الجواب :
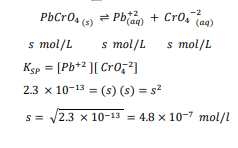
السؤال : 𝐾𝑆𝑃 لفلوريد الإسكانديوم ScF3 عند درجة حرارة 298 K يساوي 4.2×10 .اكتب معادلة الاتزان الكيميائية لذوبانية فلوريد الإسكانديوم في الماء . ما تركيز أيونات Sc +3 للازمة لتكوين راسب إذا كان تركيز أيون الفلوريد M076.0
الجواب :
السؤال : هل يتكون راسب عند خلط ml 6.62 من CaCl2 الذي تركيزه m 0322.0 مع 3.31 من NaOH الذي تركيزهm 0145.0 ؟ استعمل البيانات الموجودة في الجدول 3ــ4 . وضح إجابتك .
الجواب :

السؤال : صناعة ايثانوات انإيثيل 3𝐶𝐻2𝐶𝑂𝑂𝐶𝐻CH3 مذيب يستعمل في صناعة الورنيش ، ويمكن إنتاجه بتفاعل الإيثانول وحمض : الايثانويك ( الخليك ) يمكن وصف الاتزان بالمعادلة
𝐶𝐻3𝐶𝑂𝑂𝐻 + 𝐶𝐻3𝐶𝐻2𝑂𝐻 ⇌ CH3𝐶𝑂𝑂𝐶𝐻2𝐶𝐻3 + 𝐻2𝑂
احسب Kepباستعمال تراكيز الاتزان الآتية
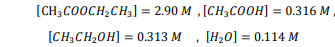
الجواب :
مراجعة عامة
السؤال : تنتج ايثانوات الإيثيل 𝐶𝐻3𝐶𝑂𝑂𝐶𝐻2CH3 من الاتزان الموصوف في المعادلة الآتية :
𝐶𝐻3𝐶𝑂𝑂𝐻 + 𝐶𝐻3𝐶𝐻2𝑂𝐻 ⇌ CH3𝐶𝑂𝑂𝐶𝐻2𝐶𝐻3 + 𝐻2𝑂
لماذا تسبب إزالة الماء إنتا المزيد من ايثانوات الإيثيل ؟
الجواب : تؤدي إزالة الماء H2Oإلى إزاحة الاتزان نحو اليمين ، وبالتالي إنتاج المزيد من ايثانوات الإيثيل .
السؤال : كيف يتأثر كل اتزان فيما يلي بانخفاض درجة الحرارة ؟

السؤال : كيف يتأثر كل اتزان فيما يلي بارتفاع كل من درجة الحرارة والحجم في الوقت نفسه ؟
2𝑂3. (𝑔) ⇌ 3𝑂2(𝑔) + حرارة
الجواب : ستؤدي زيادة درجة الحرارة إلى انزياح الاتجاه نحو اليسار ، وتؤدي زيادة الحجم إلى انزياح الاتجاه نحو اليسار أيضاً ( عدد مولات أقل ) .
b.
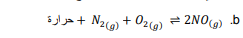
الجواب : ستؤدي زيادة درجة الحرارة إلى انزياح الاتجاه نحو اليمين ، لكن زيادة الضغط لا تؤدي إلى أي تغير ( عدد المولات متساوي على الطرفين )
السؤال : .ثابت حاصل الذوبانية لزرنيخات الرصاص II
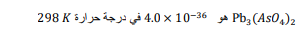
احسب الذوبانية بوحدة Mol/l لهذا المركب عند درجة الحرارة نفسها ؟
الجواب :
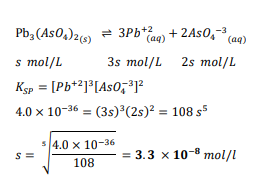
السؤال : صحح الجملة الآتية : القيمة المنخفضة لثابت الاتزان Keq تعني أن كلا التفاعلين الامامي والعكسي يحدثان ببطء .
الجواب : الجملة ليست صحيحة Keq لا تعطي أي معلومات حول سرعة حدوث التفاعل أو بطئه .
وتعني القيمة المنخفضة ل Keq فقط احتواء نظام الاتزان على تراكيز من المتفاعلات أعلى من النواتج عند حدوث التفاعلات الأمامية والعكسية بنسبة متساوية .
السؤال : في نظام الاتزان 𝑁2𝑂4 (𝑔) ⇌ 2𝑁𝑂2(𝑔) ، لون NO2 بني غامق
فسر اختلاف اللون للاتزان كما هو موضح في الشكل 22ــ4 .
الجواب : عند وجود ضغط عال ( حجم أقل ) يتجه الاتزان نحو الطرف الذي يقلل من قيمة الضغط ، ويتم ذلك بالاتجاه نحو اليسار مستهلكاً المزيد من 𝑁𝑂2 ذي اللون البين المحمر ومنتجا المزيد من N2O4 العديم اللون .
السؤال : إضافة هيدروكسيد البوتاسوم إلى محلول هيدروكسيد الألومنيوم المشبع يُقلل من تركيز أيونات الألومنيوم . اكتب معادلة اتزان الذوبانية وتعبير ثابت حاصل الذوبانية لمحلول مائي مشبع لهيدروكسيد الألومنيوم .
الجواب :
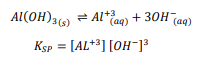
التفكير الناقد
السؤال : تحليل افترض أن نظام اتزان عند درجة حرارة معينة Keq له تساوي 1.000 ، ما احتمال أن هذا النظام يتكون من %50 متفاعالت و %50 نواتج ؟ فسر إجابتك .
الجواب : بما أن Keq هي نسبة النواتج إلى المتفاعلات ، فإنه من الممكن أن يتكون النظام من %50 متفاعلات و %50 نواتج ، ولكن ليس من الضروري أن يكون الحال كذلك ، حيث يتطلب ثابت حاصل الذائبية عندما تكون قيمته 1.000 أن يتكون القيمة العددية لنسبة تركيز النواتج إلى تركيز المتفاعلات مساوية للقيمة1.000، وذلك عندما ترفع قيمة كل تركيز إلى قوة تساوي معاملها في المعادلة الموزونة .
السؤال : تطبيق يستعمل تنشق الأملاح أحياناً لإعادة إنعاش شخص فاقد للوعي ، إذ تتكون هذه الأملاح من كربونات الأمونيوم . فإذا كانت معادلة تفكك كربونات الأمونيوم الماص للحرارة كما يأتي :
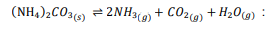
فهل تتوقع أن استنشاق الأملاح يعطي مفعولا في أيام الشتاء الباردة كما في أيام الصيف الحارة ؟ فسر إجابتك
الجواب : لا لأن التفاعل ماص للحرارة وفي فصل الشتاء تنخفض درجة الحرارة وعندها يكون اتجاه إزاحة الاتزان إلى الجهة اليسرى مما يقلل من تركيز النواتج فلا يعطى المفعول كما كان في أيام الصيف .
السؤال : إذا علمت أن Keq ليوديدات الكادميوم Cd(10^3)2 يساوي 2.3×10^-8 عند درجة حرارة K298 ، ما تركيز (l/mol ) كل من أيونات الكادميوم وأيونات اليوديدات في محلول مشبع مع يوديدات عند درجة حرارة K 298 ؟
الجواب :
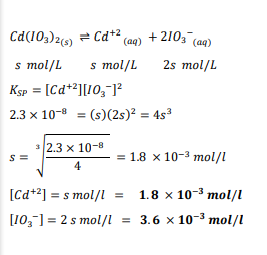
السؤال : تفسير البيانات أي المركبات يترسب أولا إذا تمت إضافة فلوريد الصوديوم الذي تركيزه M 500.0 بشكل تدرجي إلى محلول يحتوي على تركيز 0.500M من كل من أيونات الباريوم والماغنسيوم ؟
استعمل الجدول 6ــ4 واكتب معادلات اتزان الذوبانية وتعابير ثابت حاصل الذوبانية لكلا المركبين . فسر إجابتك .
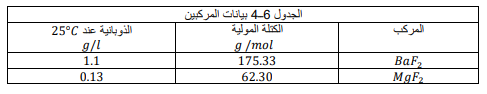
الجواب :

السؤال : السبب والنتيجة افترض أن لديك g 56.2 من خليط مكون من كلوريد الصوديوم وكلوريد الباريوم . فسر كيف يمكن استعمال تفاعل الترسيب لتحديد مقدار كل مركب في الخليط .
الجواب :
1- نذيب المخلوط في ماء مقطر
2- نضيف محلول إضافي يحتوي على الأنيون مثل الكربونات ، الكرومات والكبريتات التي ترسب أيونات الباريوم جميعها .
3 - نرشح الراسب ونجففه ونقيس كتلته .
4- نحسب عدد مولات مركب الباريوم المتكون ، الذي يساوي عدد مولات كلوريد الباريوم في المخلوط الأصلي .
5- نحسب كتلة كلوريد الباريوم في المخلوط الأصلي ، فيكون المتبقي من الخليط الأصلي هو كلوريد الصوديوم .
السؤال : قارن أي المادتين الصلبتين : فوسفات الكالسيوم وفوسفات الحديد III لها ذوبانية مولارية أكبر ؟
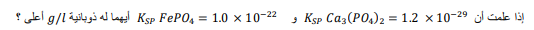
الجواب : نحسب الذائبية بال mol/l ومن ثم نحولها إلى g/l بالضرب بالكتلة المولية :

مسألة تحد
تحضير الفوسجين الفوسجين 2 𝐶𝑂𝐶𝑙غاز سما يستعمل في تصنيع الأصباغ والأدوية والمبيدات الحشرية . و يمكن تحضيره بتفاعل أول أكسيد الكربون مع غاز الكلور وفق المعادل
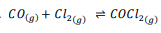
بداية وضع 1.0000molمن كلا الغازين في وعاء حجمه 10.00L وعند وصولهما إلى حالة الاتزان وجد أن تركيز كل منهما 0.0086 . ما تركيز الفوسجين عند الاتزان ؟ وما Keq للنظام ؟
الجواب :
لتركيز المولاري الابتدائي لكل منCO و 2 𝐶𝑙 يحسب من حاصل قسمة عدد مولاتها على حجم الوعاء .
1.00MOL/L-0.0086MOL/L
وإذا كان تركيز CO و 2 𝐶𝑙عند االتزان يساوي0.0086MOL/Lفإن تركيز COCl2:

مراجعة تراكمية
السؤال : عندما تقوم بعكس معادلة كيميائية حرارية لماذا يجب عكس إشارة 𝛥 H ؟
الجواب : عكس المعادلة الكيميائية الحرارية الطاردة للحرارة مثGH يجعلها ماصة للحرارة ، وعليه فبدGH من أن تكون الطاقة ناتجة عن التفاعل ، ستصبح ممتصة . لذا يجب عكس إشارة 𝛥H .
تقويم إضافي
الكتابة في الكيمياء
السؤال : مركب جديد تخيل أنك عالم ، وقد قمت بتركيب سائل فريد وجديد وأسميته يولان ومختصره يو .
يولان سائل غير سام ، وتحضيره غير مكلف ، وله القدرة على إذابة كمية كبيرة من غاز ثاني أكسيد الكربون وفق معادلة الاتزان :
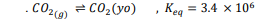
السؤال : اكتب مقالة لمجلة أو صفيحة تفسر فيها ميزة يولان في مكافحة الارتفاع في درجات الحرارة العالمي .
الجواب : نلاحظ أن ثابت اتزان التفاعل هو رقم كبير ( حيث يمتص ثاني أكسيد الكربون ) ، وعليه فالتفاعل ذو كفاءة عالية في إزالة كمية ثاني أكسيد الكربون الزائدة من الغلاف الجوي . بالإضافة إلى أن مادة اليولان نفسها لا تضر بالبيئة .
السؤال : عسر الماء يسبب وجود أيونات الماغنسيوم والكالسيوم في الماء عسره .فسر بالاعتماد على الذوبانية لماذا يعد وجود هذين الأيونين أحيانا . غير مرغوب فيه . ثم أوجد الطرائق التي يمكن اتخاذها للحد منهما
الجواب :
الآثار غير المرغوب بها لوجود هذين الأيونين في الماء :
1- تؤدي قلة ذائبية بعض مركبات الماغنسيوم والكالسيوم إلى إتلاف التمديدات الصحية ، وتقليل فاعليتها .
2- كما أن قلة ذائبية 4 𝐶𝑎𝑆𝑂في الماء الساخن ستؤدي إلى إتلاف الأنابيب الناقلة لها
3- تتفاعل أيونات الصابون أقل فاعلية ،ومكونة ترسبات على المغاسل. الماغنسيوم والكالسيوم مع الصابون مكونة مركبات غير ذائبة ،جاعلة طرائق يمكن اتخاذها للحد من هذين الأيوني
4- يمكن إزالة أيونات الكالسيوم والماغنسيوم من خلال التنقية ، أو تفاعلات الاستبدال
5- يمكن معالجة الماء الساخن بإضافة كربونات الصوديوم ، مما يؤدي إلى ترسيب كربونات الكالسيوم ، ومنع تكوين 4 𝐶𝑎𝑆𝑂في الأنابيب الناقل
أسئلة المستندات
التلوث تحتوي عوادم السيارات على الملوثات الخطرة : أول أكسيد النيتروجين NO وأول أكسيد الكربون CO . ويمكن أن تقلل كمية هذين . الغازين في الهواء الجوي بتمريرهما فوق سبيكة ( عامل محفز ) .
عندما يمر غازا NO و CO فوق هذا المحفز ينشأ الاتزان الآتي :
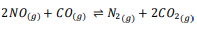
ويتأثر ثابت الاتزان بدرجة الحرارة ، كما هو موضح في الجدول 7ــ4
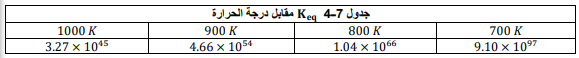
السؤال : كتب تعبير ثابت الاتزان لهذا الاتزان .
الجواب :
السؤال : ادرس العلاقة بين Keq ودرجة الحرارة . استعمل مبدأ لوتشاتلييه لاستنتاج ما إذا كان التفاعل الأمامي ماصاً أم طاردا للطاقة
الجواب : بما ان قيمة Keq تتناقص مع ازدياد درجة الحرارة لذا نستنتج أن التفاعل الأمامي طارد للحرارة .
السؤال : فسر كيف أن الرادييتر ( مبرد السيارة ) المطلي بالسبيكة يمكن أن يساعد على تقليل تركيز NO و CO في الغلاف الجوي ؟
الجواب : عندما يمر غازا NO، CO على السبيكة المطلى بها الرادييتر فإن هذه السبيكة تعمل كعامل محفز يزيد من سرعة التفاعل بين NO وCO فيتكونNO2، CO2 مما يقلل من تركيز NO و CO في الغلاف الجوي
حل اختبار مقنن الفصل الرابع الاتزان الكيميائي

أسئلة الاختيار من متعدد
السؤال : أي مما يأتي يصف نظاماً وصل إلى حالة الاتزان الكيميائي ؟
a . لايوجد ناتج جديد يتكون بفعل التفاعل الأمامي .
b . لا يحدث التفاعل العكسي في النظام .
c .تركيز المتفاعلات في النظام يساوي تركيز النواتج .
d .سرعة حدوث التفاعل الأمامي تساوي سرعة حدوث التفاعل العكسي .
الجواب الصحيح : d .سرعة حدوث التفاعل الأمامي تساوي سرعة حدوث التفاعل العكسي .
السؤال :

استعمل الرسوم الآتية للإجابة عن السؤال 3
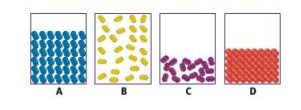
السؤال : أي الرسوم الأربعة يبين المادة التي لها أضعف قوى بين جزيئية ؟
A .a
B .b
C .c
D .d
الجواب الصحيح : D .d
السؤال : أي نوع من القوى بين الجزيئية ينتج عن عدم توازن مؤقت في الكثافة الإكترونية حول نواة الذرة ؟
a .الروابط الأيونية
b .قوى التشتت
c .قوى ثنائية القطب
d .الروابط الهيدروجينية .
الجواب الصحيح : b .قوى التشتت
استعمل الجدول الآتي للإجابة عن الاسئلة التالية
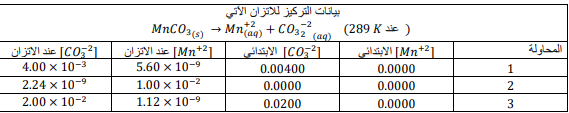
السؤال : ما قيمة Ksp ل MnCO3 عند درجة حرارة K 298 ؟
a.2.24×10^-11
10^×b.4.00
c.1.12×10-9
d.5.60×10-9
الجواب الصحيح : a.2.24×10^-11
طريقة الحل :
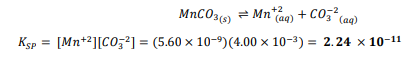
السؤال : ما ذوبانية 3 𝑀𝑛𝐶𝑂عند درجة حرارة K 298 ؟
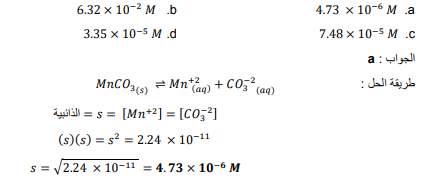
السؤال : عند خلط 50ml من K2CO3 الذي تركيزه 3.00×10 معml 50 من MnCL2 سوف يتكون راسب من 3 𝑀𝑛𝐶𝑂فقط عندما يكون تركيز محلول MnCl2 أكبر من :
الجواب :

اسئلة الإجابات المفتوحة
السؤال : اكتب تعبير ثابت الاتزان لكل اتزان غير متجانس فيما يلي :
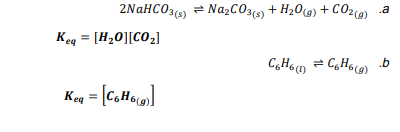
السؤال : ينتج عن تسخين الحجر الجيري 3𝐶𝑎𝐶𝑂 الجير الحي CaO وغاز ثاني أكسيد الكربون .اكتب تعبير ثابت الاتزان للتفاعل العكسي .
الجواب : ( 𝑲𝒆𝒒 = 𝑪𝑶𝟐
اسئلة الإجابات المفتوحة
استعمل المخطط الآتي للإجابة عن الأسئلة من 10-12
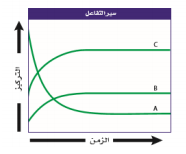
السؤال : صف شكل الرسم البياني عند حدوث الاتزان . ؟
الجواب : عند حدوث الاتزان تصبح الخطوط أفقية ، حيث تبقى تراكيز المتفاعلات والنواتج ثابتة عند هذه النقطة .
السؤال : فسر لماذا لا يساوي تركيز المتفاعلات صفراً عند نهاية هذا التفاعل ؟
الجواب : لا يساوي تركيز المتفاعلات صفراً في نهاية التفاعل ، لأن التفاعل في حالة اتزان . وحتى يُنتج التفاعل العكسي مزيداً من النواتج يجب أن تكون سرعته مساوية لسرعة التفاعل الأمامي الذي يَستهلك المتفاعلات .
السؤال : صف شكل الرسم البياني عند حدوث الاتزان . ؟
الجواب : عند حدوث الاتزان تصبح الخطوط أفقية ، حيث تبقى تراكيز المتفاعلات والنواتج ثابتة عند هذه النقطة .
السؤال : فسر لماذا لا يساوي تركيز المتفاعلات صفراً عند نهاية هذا التفاعل ؟
الجواب : لا يساوي تركيز المتفاعلات صفراً في نهاية التفاعل ، لأن التفاعل في حالة اتزان . وحتى يُنتج التفاعل العكسي مزيداً من النواتج يجب أن تكون سرعته مساوية لسرعة التفاعل الأمامي الذي يَستهلك المتفاعلات .
السؤال : صنف نوع التفاعل الكيميائي الذي يظهر في هذا الرسم البياني ، وكسف تدعم البيانات فسه استنتاجك ؟
الجواب : يعد هذا التفاعل – على لأغلب – تفاعل تفكك .حيث يوجد هناك متفاعل واحد يظهره المنحنى A وتقل ذائبيته كلما استهلك . كما أن هناك ناتجين ممثلين في الخطين B و C تزداد ذائبيتها بازدياد الزمن ، حيث إنهما يتكونان من تفكك A .









